
【题目】有关药品保存正确的是( )
A.锂保存在煤油中
B.液溴保存在带橡皮塞的棕色细口玻璃瓶中
C.白磷保存在水里
D.碘单质保存在无色广口瓶中
科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
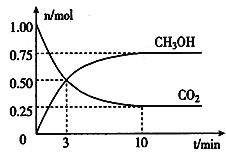
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________。
②达到平衡时,H2的转化率为__________。
③该反应的平衡常数K=___________________(表达式)。
④下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究H2S的性质,装置如图所示。

下列说法正确的是( )
A. 若F中产生黑色沉淀,则说明H2SO4的酸性比H2S强
B. 若G中产生浅黄色沉淀,则说明H2S的还原性比Fe2+强
C. 若H中溶液变红色,则说明H2S是二元弱酸
D. 若E中FeS换成Na2S,该装置也可达到相同的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
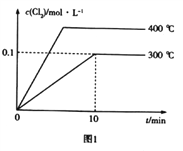
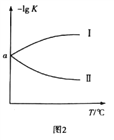
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于目前常用元素周期表的说法中正确的是( )
A.第ⅢB族元素种类最多
B.只有第3列到第12列全部是金属元素
C.周期数大于或等于族的序数时,一定是金属元素
D.是按原子的质量数由小到大的顺序编制的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
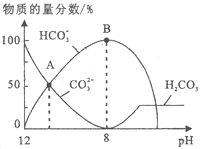
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 丙烯与氯化氢加成的产物有2种 B. 联二苯![]() 的二氯取代物有15种
的二氯取代物有15种
C. 立方烷![]() 的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
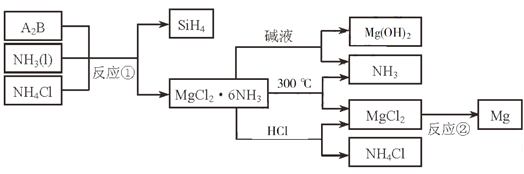
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
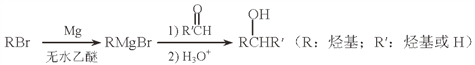
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年1月11日,中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一。下列有关推断不正确的是( )
A. 钛的原子序数为22 B. 钛位于元素周期表第四周期
C. 钛原子核外电子排布式为1s22s22p63s23p63d4 D. 钛属于过渡元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com