
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
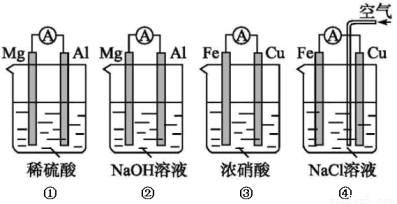
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e -=H2↑
-=H2↑
科目:高中化学 来源: 题型:多选题
| A. | 4:3 | B. | 7:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
在日常生活中,我们经常看到铁制品生锈、钒制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )

A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图II是图I所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电 极反应:2Cl--2e-=Cl2↑
极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
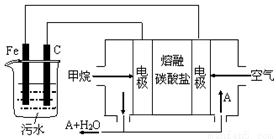
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应分别是
①_____________________________________;
②_____________________________________。
(3)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应_______________________.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_____________。
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
(5)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。
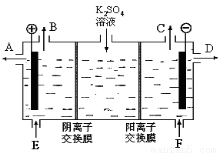
请回答:a为________(填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)为:______________;写出此时电解反应的总化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法正确的是
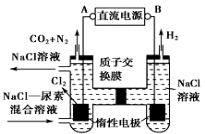
A.B为电源的正极
B.电解结束后,阴极室溶液的pH升高
C.电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g),忽略固体体积,平衡时C的体积分数
2C(g),忽略固体体积,平衡时C的体积分数 (%)随温度和压强的变化如下表所示:
(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
800 | 54.0 | a | b |
900 | c | 75.0 | d |
1000 | e | f | 83.0 |
①a﹤b ②该反应的熵变△S﹤0 ③900℃、2.0MPa时A的转化率为60%
④K(1000℃)﹥K(800℃) ⑤正反应为吸热反应 上述①~⑤中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com