
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:
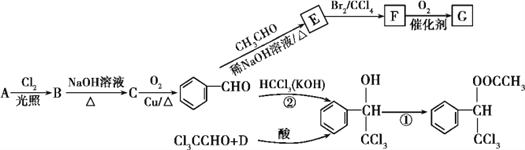
已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体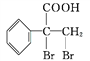 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
【答案】 甲苯 羧基 加成反应 ![]()
![]() 酸性高锰酸钾溶液 4
酸性高锰酸钾溶液 4 ![]() +CH3COOH
+CH3COOH![]()
![]() +H2O
+H2O 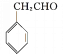
![]()
![]()
![]()
![]()
【解析】由C→![]() 及反应条件可知C为苯甲醇,B为
及反应条件可知C为苯甲醇,B为![]() ,A为甲苯。在相同条件下,D的蒸气相对于氢气的密度为39,则D的相对分子质量为39×2=78,D与A互为同系物,由此知D为芳香烃,设1个D分子中含有n个碳原子,则有14n-6=78,解得n=6,故D为苯;
,A为甲苯。在相同条件下,D的蒸气相对于氢气的密度为39,则D的相对分子质量为39×2=78,D与A互为同系物,由此知D为芳香烃,设1个D分子中含有n个碳原子,则有14n-6=78,解得n=6,故D为苯;![]() 与乙醛反应得到E,结合信息①,E为
与乙醛反应得到E,结合信息①,E为![]() ,E与溴发生加成反应得到的F为
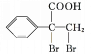
,E与溴发生加成反应得到的F为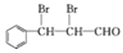 ,F发生氧化反应生成的G为
,F发生氧化反应生成的G为![]() 。
。
(1)根据分析可知,A为甲苯,G为![]() ,则G中含氧官能团为羧基,故答案为:甲苯; 羧基;
,则G中含氧官能团为羧基,故答案为:甲苯; 羧基;
(2)反应②为苯甲醛与氯仿发生加成反应生成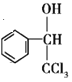 ,根据上述分析,B和F的结构简式分别为
,根据上述分析,B和F的结构简式分别为![]() 、
、![]() ,故答案为:加成反应;
,故答案为:加成反应;![]() ;
;![]() ;
;
(3)甲苯能使酸性高锰酸钾溶液褪色,而苯不能;C为苯甲醇属于芳香族化合物的苯甲醇的同异构体有邻甲基苯酚、间甲基苯酚、对甲基苯酚和苯甲醚(![]() ),共4种,故答案为:酸性高锰酸钾溶液;4;
),共4种,故答案为:酸性高锰酸钾溶液;4;
(4)反应①为乙酸和![]() 发生酯化反应,化学方程式为
发生酯化反应,化学方程式为![]() +CH3COOH
+CH3COOH![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +CH3COOH
+CH3COOH![]()
![]() +H2O;
+H2O;
(5)苯乙醛与甲醛反应生成![]() ,
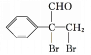
,![]() 再与溴发生加成反应生成
再与溴发生加成反应生成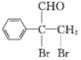 ,最后
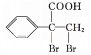
,最后 发生催化氧化反应生成
发生催化氧化反应生成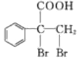 ,故合成路线为
,故合成路线为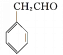
![]()
![]()
![]()
![]()
 ,故答案为:
,故答案为:
![]()
![]()
![]()

![]()
 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)某元素X基态原子的最外层有3个未成对电子,次外层有2个电子,其价电子排布图为___,其原子核外有___种不同运动状态的电子;其最低价氢化物电子式为___,中心原子采用___杂化,分子立体构型为___。
(2)某元素Y基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其元素名称为___,Y+的外围电子排布式为___,该元素固体单质常常采用___堆积方式,配位数为___,空间利用率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )

A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿![]() 主要成分为
主要成分为![]() ,另含少量铁,钙,铜等金属化合物
,另含少量铁,钙,铜等金属化合物![]() 作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的![]() ,又制得电池材料
,又制得电池材料![]() 反应条件已省略
反应条件已省略![]()
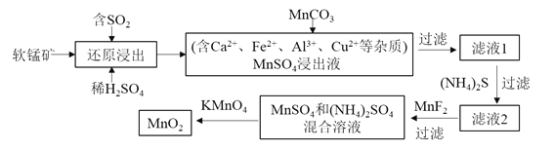
请回答下列问题:
![]() 上述还原浸出是脱硫过程,实现了 ______
上述还原浸出是脱硫过程,实现了 ______ ![]() 选填编号
选填编号![]() .
.
![]() 废气物的综合利用
废气物的综合利用
![]() 臭氧层空洞的减少
臭氧层空洞的减少
![]() 白色污染的减少
白色污染的减少
![]() 酸雨的减少
酸雨的减少
![]() 写出上述软锰矿经还原浸出生成
写出上述软锰矿经还原浸出生成![]() 的化学方程式是 ______ .
的化学方程式是 ______ .
![]() 用
用![]() 能除去还原浸出液中的
能除去还原浸出液中的![]() ,请用离子方程式解释其原因是 ______ .
,请用离子方程式解释其原因是 ______ .
![]() 加入
加入![]() 的目的主要是除去 ______ ;加入
的目的主要是除去 ______ ;加入![]() 的目的主要是除去 ______ ;
的目的主要是除去 ______ ;![]() 填离子符号
填离子符号![]()
![]() 下列各组试剂中,能准确测定一定体积燃煤尾气中
下列各组试剂中,能准确测定一定体积燃煤尾气中![]() 含量的是 ______
含量的是 ______ ![]() 填编号
填编号![]()
a.NaOH溶液、石蕊试液
b.稀![]() 酸化的
酸化的![]() 溶液
溶液
c.碘水、淀粉溶液
d.氨水、石蕊试液
![]() 用电化学法模拟工业处理
用电化学法模拟工业处理![]() 将硫酸工业尾气中的
将硫酸工业尾气中的![]() 通入如图装置
通入如图装置![]() 电均为惰性材料
电均为惰性材料![]() 进行实验,可用于制备硫酸,同时获得电能:
进行实验,可用于制备硫酸,同时获得电能:
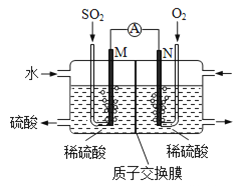
![]() 极发生的电极反应式为 ______ .
极发生的电极反应式为 ______ .
![]() 若使该装置的电流强度达到
若使该装置的电流强度达到![]() ,理论上每分钟应向负极通入标准状况下气体的体积为 ______
,理论上每分钟应向负极通入标准状况下气体的体积为 ______ ![]() 保留3位小数,已知:1个
保留3位小数,已知:1个![]() 所带电量为
所带电量为![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4个碳原子间均以单键结合的方式有4种,请在下面的方框中补充另外3种结合方式:________________

(2)写出碳原子数为5的烷烃的同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是
2CO(g),达到平衡状态的标志是
A. 单位时间内生成nmolCO2的同时生成2nmolCO
B. 单位时间内生成nmolCO2的同时生成nmolC
C. 混合气体的密度不再改变的状态
D. 混合气体的压强不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 等体积 | 相同时间内 |
|
B | 将湿润的淀粉- | 试纸只在 | 氧化性: |
C | 将光亮的镁条放入盛有 | 有大量气泡产生 | 生成的气体是 |
D | 向NaHCO3溶液中加入NaAlO2溶液 | 有白色沉淀生成 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
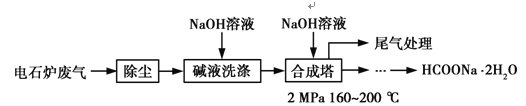
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
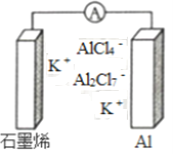
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com