
银氨溶液可用于检测CO气体。实验室研究该反应的装置图如下:
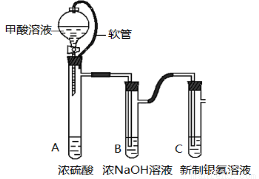
(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有 (填“氧化性”或脱水性)。
(2)软管的作用是 。
(3)浓NaOH溶液的作用是 。
(4)反应结束后试管C底部有黑色沉淀,为验证产物,分离出上层清液和底部黑色固体,并进行实验。
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
d.将黑色沉淀用蒸馏水洗净。
① 实验c的目的是 。
② 根据上述实验现象证明上层清液中含有 。
③ 已知银可溶于浓硝酸,设计实验证明黑色固体是Ag单质:
④ CO与银氨溶液反应中有氨气生成,根据实验现象写出该反应的化学方程式: 。
(1)脱水性 (2)保证分液漏斗和试管A内气压相同使甲酸溶液可以顺利滴下。
(3)洗气,吸收酸性气体
(4)①对比试验,证明Ba(OH)2溶液不能与银氨溶液反应,证明实验b中的现象是产物与Ba(OH)2溶液反应导致的。②(NH4)2CO3或NH4+、CO32— 。③取少量黑色固体,向其中滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。CO+ 2Ag(NH3)2OH=(NH4)2CO3+2Ag↓+2NH3↑
【解析】
试题分析:(1)甲酸与浓硫酸共热发生反应:HCOOH CO↑+H2O。在该反应中浓硫酸的作用是脱水性。(2)软管的作用是使分液漏斗的上下气体压强相同,这样分液漏斗中的液体在重力的作用下就可以顺利滴下。(3)甲酸在加热时会挥发,也可能部分CO被氧化为CO2,所以浓NaOH溶液的作用是洗气,吸收酸性气体。(4)a.测得上层清液pH为10,证明溶液为碱性;b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。证明含有NH4+;同时证明在溶液中含有的离子能与Ba(OH)2电离产生的离子结合形成白色难溶性物质。根据反应物及所含元素可确定产生的白色沉淀为BaCO3。c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。d.CO被银氨溶液氧化为CO32—,它本身则被还原为Ag单质。疏松的Ag颗粒在室温下为黑色固体。将黑色沉淀用蒸馏水洗净就得到单质Ag。① 实验c的目的是是为了与b形成对照,证明Ba(OH)2溶液不能与银氨溶液反应,实验b中的现象是产物与Ba(OH)2溶液反应导致的。② 根据上述实验现象证明上层清液中含有(NH4)2CO3或NH4+、CO32—。③证明黑色固体是Ag单质实验方案是取少量黑色固体,向其中滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。④根据实验现象可知CO与银氨溶液反应的化学方程式为CO+ 2Ag(NH3)2OH=(NH4)2CO3+2Ag↓+2NH3↑。
CO↑+H2O。在该反应中浓硫酸的作用是脱水性。(2)软管的作用是使分液漏斗的上下气体压强相同,这样分液漏斗中的液体在重力的作用下就可以顺利滴下。(3)甲酸在加热时会挥发,也可能部分CO被氧化为CO2,所以浓NaOH溶液的作用是洗气,吸收酸性气体。(4)a.测得上层清液pH为10,证明溶液为碱性;b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。证明含有NH4+;同时证明在溶液中含有的离子能与Ba(OH)2电离产生的离子结合形成白色难溶性物质。根据反应物及所含元素可确定产生的白色沉淀为BaCO3。c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。d.CO被银氨溶液氧化为CO32—,它本身则被还原为Ag单质。疏松的Ag颗粒在室温下为黑色固体。将黑色沉淀用蒸馏水洗净就得到单质Ag。① 实验c的目的是是为了与b形成对照,证明Ba(OH)2溶液不能与银氨溶液反应,实验b中的现象是产物与Ba(OH)2溶液反应导致的。② 根据上述实验现象证明上层清液中含有(NH4)2CO3或NH4+、CO32—。③证明黑色固体是Ag单质实验方案是取少量黑色固体,向其中滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。④根据实验现象可知CO与银氨溶液反应的化学方程式为CO+ 2Ag(NH3)2OH=(NH4)2CO3+2Ag↓+2NH3↑。
考点:考查银氨溶液在检测CO气体的应用的实验操作、反应原理及化学方程式的书写的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是(N A表示阿伏加德常数)
A.1molCu与足量硫反应生成Cu2S,转移的电子数为2 N A
B.R2+的质量数为A,中子数为N,则ngR该价态的氧化物中含质子数为 N A
N A
C.氯化铁生成Fe(OH)3 胶体的离子方程式:Fe3++3H2O =Fe(OH)3↓+3H+
D.在加入铝片能生成氢气的溶液中一定共存的离子组:Na+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是

A.气态氢化物的稳定性:N>R
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物既含离子键又含共价键
D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.糖类、油脂和蛋白质都是人体所需要的营养素
B.节日焰火的五彩缤纷是某些金属单质性质的体现
C.化学反应能够制造出新的物质,同时也能制造出新的元素
D.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) + 3/2O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) + 1/2O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
A.升高温度,可使①②反应速率均加快
B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C.NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l) ΔH = -346kJ/mol
D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
用如图所示装置进行实验,实验现象正确的是
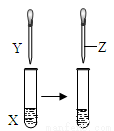
| X | Y | Z | 实验现象 |
A | 苯酚浑浊液 | NaOH溶液 | 盐酸 | 浑浊液变澄清,后又变浑浊 |
B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 溶液变为红色,后颜色加深 |
C | KI溶液 | 足量氯水 | 乙醇
| 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
D | Na2SO3溶液 | Ba(NO3)2溶液 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
①A是一种有机酸,分子式为C9H10O3。
②B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
③C的相对分子质量为78,且分子中只有一种氢原子。
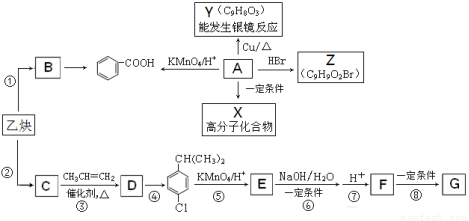
(1)写出乙炔分子的电子式 , F中的含氧官能团名称 ;
(2)上述①至⑧的反应中,属于加成反应的有 ,第④步反应所需的试剂和条件是 ;
(3)写出A的结构简式 ;
(4)下列有关的描述中,正确的是 ;
a. 1molB最多能与4molH2加成
b. B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c. B、C、D是同系物
d. A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离。
B.实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯。
C.从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取。
D.向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)
如图所示,是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答:
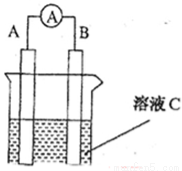
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com