
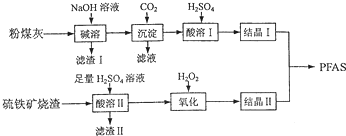
分析 粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3、FeO和氢氧化钠不反应,滤液中通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;过滤,滤渣中再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;
硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+2H+=Fe2++H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS;
(1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;净化水是除去悬浮杂质,软化水是除去钙镁离子;
(2)加入NaOH溶液使Al2O3溶解生成偏铝酸钠和水;
(3)氧化亚铁与氢离子反应生成亚铁离子和水;四氧化三铁和酸反应生成铁盐、亚铁盐、水;
(4)H2O2氧化Fe2+时,温度不能过高,其原因是温度过高,H2O2会分解;
(5)“氧化”时若ClO2用代替H2O2,发生反应是酸溶液中ClO2氧化亚铁离子为铁离子,ClO2被还原为氯离子.
解答 解:粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3、FeO和氢氧化钠不反应,滤液中通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;过滤,滤渣中再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;
硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+2H+=Fe2++H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS;
(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁等;水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:硫酸铝、硫酸铁;铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(2)氧化铝为两性氧化物,“碱溶”时,Al2O3发生反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3、FeO和氢氧化钠不反应,所以滤渣I为Fe2O3、FeO;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Fe2O3、FeO;
(3)硫铁矿烧渣主要成分为Fe3O4、FeO、SiO2等,加酸溶解时,四氧化三铁和氧化亚铁与氢离子反应,四氧化三铁中铁$\frac{1}{3}$为+2,$\frac{2}{3}$为+3,“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,FeO与氢离子反应为:FeO+2H+=Fe2++H2O;
故答案为:FeO+2H+=Fe2++H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)过氧化氢氧化亚铁盐为铁盐,2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2氧化Fe2+时,“氧化”时应控制温度不超过57℃,其原因是温度不能过高,其原因是温度过高,H2O2会分解,
故答案为:温度过高,H2O2会分解;
(5)“氧化”时若ClO2用代替H2O2,发生反应是酸溶液中ClO2氧化亚铁离子为铁离子,ClO2被还原为氯离子,反应离子方程式为5Fe2++ClO2+4H+═5Fe3++Cl-+2H2O,
故答案为:5Fe2++ClO2+4H+═5Fe3++Cl-+2H2O.
点评 本题考查了物质分离提纯实验方案设计,侧重于考查物质性质的理解应用、离子方程式、化学方程式书写方法、盐类水解分析应用等,注意把握氧化还原反应方程式的配平方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
.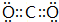 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
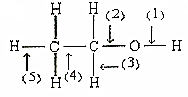 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.336L | B. | 0.448L | C. | 0.896 L | D. | 1.344L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
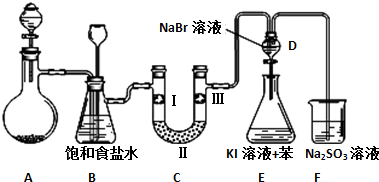
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者均属于离子化合物 | |
| B. | 两种化合物中所含有化学键类型相同 | |
| C. | Na3N与盐酸反应可得到2种盐 | |
| D. | Na3N中N3-半径比Na+半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中不含有氧原子 | |
| B. | 该有机物分子中含一个氧原子 | |
| C. | 该有机物一个分子中含2个氧原子 | |
| D. | 不能确定该有机物分子中是否含有氧原子及其个数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com