
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
分析 X原子的最外层电子数是核外电子层数的3倍,则核外各电子层的电子分别为2、6,应为O元素,X、Z同主族,则Z为S元素,W为短周期元素,而且W的原子序数大于S,所以W为Cl元素,Y是短周期主族元素中原子半径最大的,则Y为Na元素,结合元素的性质及元素周期律分析解答该题.
解答 解:X原子的最外层电子数是核外电子层数的3倍,则核外各电子层的电子分别为2、6,应为O元素,X、Z同主族,则Z为S元素,W为短周期元素,而且W的原子序数大于S,所以W为Cl元素,Y是短周期主族元素中原子半径最大的,则Y为Na元素.
A、HCl为强酸,Cl-不水解,故A错误;
B、Cl元素的最高价氧化物对应水化物的酸性一定强于S,不是最高价氧化物的水化物的酸性不能判断酸性强弱,故B错误;
C、X、Y、Z分别为X为O、Na、S,三种元素形成的化合物由Na2SO3、Na2SO4、Na2S2O3等,故C正确;
D、氢化物的稳定性与共价键有关,与氢键无关,O-H键能大于H-S键能,所以H2O的稳定性大于H2S,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
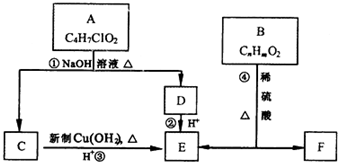
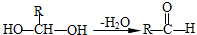
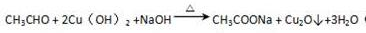

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
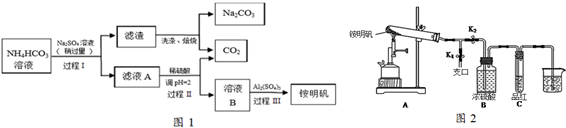
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
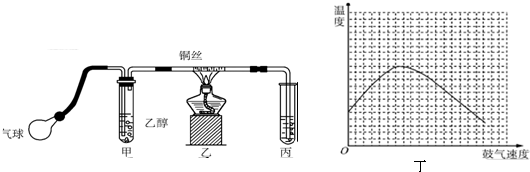
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
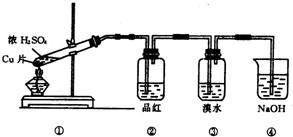
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
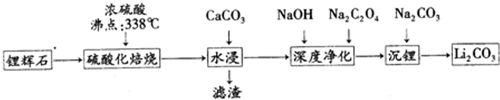
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
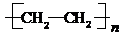 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com