
密度为1.18g/![]() 的盐酸,物质的量浓度为12mol/L,该盐酸用等质量的水稀释后,所得溶液的物质的量浓度为
的盐酸,物质的量浓度为12mol/L,该盐酸用等质量的水稀释后,所得溶液的物质的量浓度为
[ ]
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
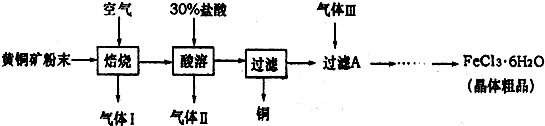

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:013
密度为1.18g/![]() 的盐酸,物质的量浓度为12mol/L,该盐酸用等质量的水稀释后,所得溶液的物质的量浓度为
的盐酸,物质的量浓度为12mol/L,该盐酸用等质量的水稀释后,所得溶液的物质的量浓度为
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:038
标准状况下,用一定量的水吸收HCl气体后制得浓度为11.8 mol·![]() ,密度为1.18g·
,密度为1.18g·![]() 的盐酸.试计算1体积水吸收多少体积的HCl气体可制得上述盐酸.(本题中HCl的式量以36.5计,水的密度以1.00 g·
的盐酸.试计算1体积水吸收多少体积的HCl气体可制得上述盐酸.(本题中HCl的式量以36.5计,水的密度以1.00 g·![]() 计)
计)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com