
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 1/2O2(g) ═ CO2(g) + 2H2(g) △H=-a kJ·mol-1,则a 726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为 。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) △H= 。
【答案】(1)M(2)<
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) △H=-290kJ·mol-1
(4)98kJ (5)-1641.0 kJ·mol-1
【解析】
试题分析:(1)M转化为N是吸热反应,所以N的能量高,能量越高越不稳定,能量越低越稳定,故稳定性M>N;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<726.5;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=﹣290kJmol﹣1 ;
(4)Al元素化合价从0价升高到+3价,因此所给反应中转移12个电子,故每转移1 mol电子放出的热量为1176kJ÷12=98kJ;
(5)已知:① Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
② CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
③ C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则关键盖斯定律可知(③×3-①-②×3)×2即得到4Fe(s)+3O2(g)=2Fe2O3(s)的△H=-1641.0 kJ·mol-1。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图表示从原混合物中分离出X的两种方案、下列说法不合理的是

A. 若含X的混合物为溴水,可通过方案I进行分离,加入试剂为CCl4液体,充分振荡后液体分层,下层为X的CC14溶液
B. 若含X的混合物为BaSO4和BaSO3的混合物,可通过方案Ⅱ进行分离,加入试剂为稀硝酸,X为BaSO4
C. 若含X的混合物为乙醇和乙酸乙酯的混合物,可通过方案I进行分离,加入试剂为饱和NaOH溶液,残留液中含有乙酸钠
D. 若含X的混合物为Fe、Al,可通过方案II进行分离,加入的试剂是过量的NaOH溶液,1molX与足量氯气完全反应时,转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的无法实现的是( )
A.用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体
B.用KSCN溶液鉴别Fe3+和Fe2+
C.用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+
D.在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH-
C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是
A.78g Na2O2晶体中所含阴、阳离子个数共为4NA
B.HBr的电子式为![]()
C.3.4g氨气中含有0.6NA个N——H键
D.PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 生物界中含量最多的三种元素是O、C、H,因此非生物界中含量最多的三种元素也是O、C、H
B. 相对于自由水,结合水在细胞中的作用较小
C. 活细胞中无机盐含量最少,功能最小
D. 结合水、无机盐在细胞中含量均较少,但作用不能被取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知体积为2L的恒容密闭容器中发生反应:2SO2(g) + O2(g)![]() 2SO3(g),请根据化学反应的有关原理同答下列问题
2SO3(g),请根据化学反应的有关原理同答下列问题
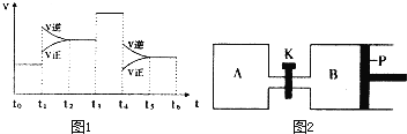
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为_____________________。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)___________。
①混合气体的密度不变 ②混合气体的平均相对分子质量不变
③ v正(SO2)=2v正(O2) ④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3 的百分含量最高的是( )
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是__________;
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为___________。
②若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com