
【题目】CO、SO2是常见的大气污染物,应用化学原理变废为宝,意义重大。
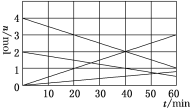
(1)CO与SO2用铝矾土作催化剂、475 ℃条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应过程中各组分的物质的量与反应时间的关系如图所示,该反应的化学方程式为________。
(2)利用CO可以合成新能源物质——甲醇。其原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
50 ℃ | 100 ℃ | 200 ℃ | 300 ℃ | 400 ℃ | |
p1 | 0.65 | 0.50 | 0.40 | 0.32 | 0.24 |
p2 | 0.80 | 0.70 | 0.65 | 0.50 | 0.41 |
①ΔH________0,p1________p2。(填“>”“<”或“=”)。
②压强为p2,温度为300 ℃时,该反应的平衡常数K=________。
③压强为p1,温度为100 ℃时,达到平衡后,继续向其中通入0.5a mol CO、a mol H2、0.5a mol CH3OH,则平衡时CH3OH的体积分数________(填“增大”“减小”或“不变”)。
④下列说法正确的是________。
a.当n(CO)∶n(H2)∶n(CH3OH)=1∶2∶1时,可逆反应达到平衡状态
b.平衡后向体积为V L的容器内继续充入He,平衡不移动
c.使用新型催化剂,可提高CO的平衡转化率
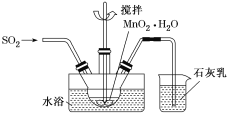
(3)MnO2悬浊液、NaOH溶液都是SO2气体常用的吸收剂。
①已知MnO2+SO2=MnSO4,吸收SO2的装置如图所示。反应过程中,为使SO2尽可能转化完全,可采取的合理措施有___________、__________。
②将标准状况下4.48 L SO2气体缓缓通入100 mL 3 mol·L-1 NaOH溶液中,充分反应后c(Na+)=___ (填几种粒子浓度之和)。
③取②中所得溶液10 mL,加水稀释成1 L,向其中加入CaCl2固体至有沉淀CaSO3(Ksp=3.1×10-7)生成,则所加CaCl2固体的质量为_____mg。
【答案】4CO+2SO2![]() 4CO2+S2 < <
4CO2+S2 < < ![]() 增大 b 缓慢通入SO2 控制合适的温度 1.5[c(SO32—)+c(HSO3—)+c(H2SO3)] 3.441
增大 b 缓慢通入SO2 控制合适的温度 1.5[c(SO32—)+c(HSO3—)+c(H2SO3)] 3.441
【解析】
(1)结合题中所给图像可知反应物、生成物的变化量,0~40min,两种反应物的变化量分别为2mol、1mol,两种生成物的变化量分别为2mol、0.5mol,反应物CO中的C为+2价,生成物CO2中的C为+4价,而反应物SO2中的S为+4价,生成物硫蒸气中的S为0价,根据氧化还原反应中得失电子守恒,以及反应物、生成物的变化量之比等于化学计量数之比,推断出硫蒸气的化学式为S2,该方程式为4CO+2SO2![]() 4CO2+S2;
4CO2+S2;
(2)①当压强一定时,温度越高,反应物的转化率越低,故该反应为放热反应,ΔH<0,由CO(g)+2H2(g)![]() CH3OH(g)的方程式可知,该反应为反应前后气体分子数减小的反应,压强越大,转化率越高,故p1<p2;
CH3OH(g)的方程式可知,该反应为反应前后气体分子数减小的反应,压强越大,转化率越高,故p1<p2; ![]()
②压强为p2,温度为300 ℃时,平衡时转化率为0.50,可知平衡时:c(CO)=0.5a/Vmol![]() L-1、c(H2)=a/Vmol
L-1、c(H2)=a/Vmol![]() L-1、c(CH3OH)=0.5a/Vmol
L-1、c(CH3OH)=0.5a/Vmol![]() L-1,该反应的平衡常数K=c(CH3OH)/c2(H2)c(CO)=
L-1,该反应的平衡常数K=c(CH3OH)/c2(H2)c(CO)=![]() ;
;
③压强为p1,温度为100 ℃时,达到平衡后,平衡时转化率为0.50,CO、H2、CH3OH的物质的量分别为0.5a mol、a mol、0.5a mol,继续向其中通入0.5a mol CO、a mol H2、0.5a mol CH3OH,各物质的浓度加倍,等效于体积压缩一半,平衡正向移动,CH3OH的体积分数增大;
④a.没有说明温度压强,当n(CO)∶n(H2)∶n(CH3OH)=1∶2∶1时,不能排判断该反应达到平衡,a错误;
b.平衡后向体积为V L的容器内继续充入He,反应物、生成物的浓度没有改变,平衡不移动,b正确; ![]()
c.使用新型催化剂,可提高反应速率,但是不能提高CO的平衡转化率,c错误;
答案选b。 ![]()
(3)①反应过程中,为使SO2尽可能转化完全,可采取缓慢通入SO2,增大SO2与MnO2的接触时间,另外也可以降低温度,因为温度越高,气体在溶液中的溶解度越小;
②n(Na+)=0.3mol,n(SO32-)+n(HSO3—)+n(H2SO3)=0.2mol,故根据物料守恒c(Na+)=1.5[c(SO32—)+c(HSO3—)+c(H2SO3)];
③ 0.2mol SO2与0.3mol NaOH反应生成0.1molNa2SO3、0.1molNaHSO3,此时c(SO32—)=0.1mol/0.1L=1mol![]() L-1,取该溶液溶液10 mL,加水稀释成1 L,稀释后c(SO32—)=0.01 mol
L-1,取该溶液溶液10 mL,加水稀释成1 L,稀释后c(SO32—)=0.01 mol ![]() L-1,c(SO32—)
L-1,c(SO32—) ![]() c(Ca2+)=0.01
c(Ca2+)=0.01![]() c(Ca2+)=3.1×10-7,c(Ca2+)=3.1×10-5 mol
c(Ca2+)=3.1×10-7,c(Ca2+)=3.1×10-5 mol![]() L-1,m(CaCl2)= 3.1×10-5 mol
L-1,m(CaCl2)= 3.1×10-5 mol![]() L-1
L-1 ![]() 1L
1L ![]() 111g
111g![]() L-1
L-1 ![]() 1000mg
1000mg![]() g-1=3.441 mg。
g-1=3.441 mg。


科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是

A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁苯辛用于治疗胃炎、胰腺炎、胆汁排泄障碍、多汗症、孕妇呕吐及遗尿。普鲁苯辛的合成路线如下:

回答下列问题:
(1)有机物A的名称是_____,F中官能团的名称是 ____。
(2)碳原子上连有四个不同的原子或基团时,该碳称为手性碳。普鲁苯辛结构式中____(填“有”或“没有”)手性碳原子。
(3)A→B的反应类型为____。
(4)C→D反应的化学方程式为____。
(5)X是C的同分异构体,X中除苯环外不含其他环状结构,X能与FeCl3溶液发生显色反应,符合条件的X 的结构有____种,其中核磁共振氢谱为3组峰,峰面积之比为1:2:2的X的结构简式为____。
(6)参考上述流程,设计以CH2=CHCH2OH、乙酸、甲醇为起始原料合成![]() 的合成线路(无机试剂任选)____
的合成线路(无机试剂任选)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。下列说法中一定正确的是
A. Ⅹ的原子半径比Y的原子半径大
B. Ⅹ形成的氢化物分子中不含非极性键
C. Z、W的最高价氧化物对应的水化物是酸
D. Y单质与水反应,水可能作氧化剂也可能作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,105℃时,1 L该混合烃与9 L O2混合,充分燃烧后恢复到原状况,所得气体体积仍为10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4、C2H4B.CH4、C3H6
C.C2H4、C3H4D.CH4、C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其它燃料电池负极(燃料)电极反应式的书写
(1)烃燃料电池
①酸性介质
CH4:1CH4—8 e—+2H2O= 1CO2+8H+
C2H6 :____________
C2H2 : ___________
②碱性介质
CH4:1CH4—8 e—+ 10OH—= 1 CO32—+ 7 H2O
C2H6:1 C2H6—14e— + 18OH—= 2CO32—+12H2O
C2H2:______________
(2)烃的含氧衍生物燃料电池
①酸性介质
CH3OH:1CH3OH—6e—+1H2O = 1CO2+6 H+
C2H5OH: ______________
CH3OCH3:_____________
②碱性介质
CH3OH: 1CH3OH—6e—+8OH —= 1CO32—+ 6 H2O
C2H5OH: ___________
CH3OCH3:___________
(3)熔融碳酸盐为电解质
负极(CH4):___________
正极(O2):______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
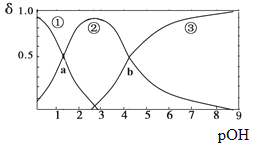
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com