
 ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���ش��������⣺
ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���ش��������⣺���� ��1��������������Һ��ˮ�����ɽ�������࣬��ˮ������������������ʹ��۳��ﵽ����Ŀ�ģ�
��2������ˮ�dz�ȥ�������ʣ�����ˮ�dz�ȥ��þ���ӣ�
��3������Ӳ��Ϊ1���ˮ��ָÿ��ˮ��10mgCaO����֮�൱�����ʣ���7.1mgMgO������ˮ�е�Ca2+��Mg2+���������CaO����������õ���
��4��Ӳˮ������Ҫ�Ѹ����Ӻ�þ����ȫ�������������������ƺ�þ���ӡ�̼��������ӷ�Ӧ������̼���Ƴ��������ӣ�
��5�������ӽ���Ĥֻ��������������ͨ���������ӽ���Ĥֻ��������������ͨ�������ص������������ӷŵ磬���������������ӷŵ磻���ݵ缫��Ӧ����д�ܵĵ�ⷴӦ��
��� �⣺��1��������������ˮ�е�С�������������۳ɽϴ�Ŀ����������ٳ�������Ҫ���ã�Ҫ�߱�ˮ�����ɽ�������ʣ����Գ������λ�������ˮ�з���ˮ��������Ӧ�������コ�壬��������������ˮ������������������������ӣ���������������������ԣ������ܾ�ˮ��ˮ�ⷽ��ʽΪAl3++3H2O?Al��OH��3+3H+��������������������������������Ҳ������ˮ�����ã����λ�������ˮ�з���ˮ��������Ӧ���������コ�壬����������Ȼˮ�������ﲢ�ƻ���Ȼˮ�е����������Ľ��壬ʹ��۳��ﵽ��ˮ��Ŀ�ģ�
�ʴ�Ϊ���������������������������������������λ�������ˮ�з���ˮ��������Ӧ���������コ�壬����������Ȼˮ�������ﲢ�ƻ���Ȼˮ�е����������Ľ��壬ʹ��۳��ﵽ��ˮ��Ŀ�ģ�
��2��ˮ�ľ����dz�ȥ���������ʣ�һ�����������У�ˮ�������ǽ���Ca2+��Mg2+��Ũ�ȣ������ܶ࣬�����ӽ�������ʯ�Ҵ���ȣ�
�ʴ�Ϊ��ˮ�ľ������û��������������ȣ���ˮ�н��弰�����������������ˮ�������dz�ȥˮ�еĸ����Ӻ�þ���ӣ�
��3��ij��Ȼˮ��c��Ca2+��=1.2��10-3mol•L-1��c��Mg2+��=6��10-4mol•L-1��Ӳ��Ϊ1���ˮ��ָÿ��ˮ��10mgCaO����֮�൱�����ʣ���7.1mgMgO����1Lˮ�и��������ʵ���=1.2��10-3mol���൱��CaO����=1.2��10-3mol��56g/mol=67.2mg��1Lˮ��þ�������ʵ���=6��10-4mol���൱������þ����6��10-4mol��40g/mol=24mg������ˮ��Ӳ��=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10�㣻
�ʴ�Ϊ��10�㣻
��4��10m3������Ȼˮˮ�к��и��������ʵ���=10��103L��1.2��10-3mol•L-1=12mol��þ�������ʵ���=10��103L��6��10-4mol•L-1=6mol��̼������������ʵ���=10��103L��8��10-4mol•L-1=8mol�������������Ʒ����ķ�ӦΪ��
Mg2++2OH-=Mg��OH��2�� HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
�������������ʵ���20mol��
��ҪCa��OH��2���ʵ���10mol��������������Ϊ74g/mol��10mol=740g��
ˮ��Һ��Ca2+���ʵ���Ϊ12mol+10mol=22mol��
������Ҫ����� ̼�������Ϊ22mol-8mol=14mol����Ҫ̼���Ƶ�����Ϊ14mol��106g/mol=1484g��
�ʴ�Ϊ��740��1484��
��5�����ص������������ӷŵ磬���������������ӷŵ磬��ĤA�������ӽ���Ĥ����ĤC�������ӽ���Ĥ������A�������ԣ�B�������ԣ�C���Լ��ԣ�����pH��С˳��Ϊ��pHa��pHb��pHc��
�ʴ�Ϊ������pHa��pHb��pHc��
���� ���⿼�����ܵ���ʼ����������ᴿ��Ϊ��Ƶ���㣬���շ����ᴿ����⡢��ѧ��Ӧ�ļ����Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |
| Mg��OH��2 | 9.6 | 11.1 |
| ���� | �۸�/Ԫ?��-1 |
| ƯҺ����25.2%NaClO�� | 450 |
| ˫��ˮ����30%H2O2�� | 2400 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+����c��HSO3-����c��SO32-����c��H+����c��OH-�� | B�� | c��Na+��+c��H+��=c��HSO3-��+c��SO32-��+c��OH-�� | ||
| C�� | c��H2SO3��+c��H+��=c��SO32-��+c��OH-�� | D�� | c��Na+��=c��HSO3-��+2c��SO32-��+c��H2SO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��a��100ʱ�����������ӷ�ӦΪ��OH-+H+=H2O | |
| B�� | ��a��300ʱ�����������ӷ�ӦΪ��OH-+3H++CO32-=2H2O+CO2�� | |
| C�� | ��100��a��200ʱ����Ӧ�����Һ��CO32-��HCO3-�����ʵ���֮��Ϊ��a��10-4-0.01������0.02-a��10-4�� | |
| D�� | ��a=200ʱ�����������ӷ�ӦΪ��OH-+2H++CO32-=H2O+HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������ձ�ը�õ�HCl���� | |
| B�� | ��HCl�ϳ�������ȼ��������ͨ����������HCl | |
| C�� | �����ڿ����е�ȼ��ͨ����������HCl | |
| D�� | ��ȼ��������������������HCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
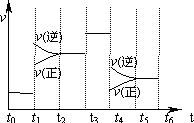
| A�� | t2��t3��t3��t4ʱ��ΰ��������������� | |
| B�� | ���������������ߵ�һ��ʱ��Ϊt5��t6 | |
| C�� | t4ʱ�̸ı�������ǽ����¶� | |
| D�� | t4��t5ʱ���ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
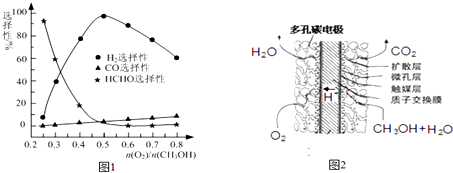
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 W��X��Y��Z��M��Q��Ϊϡ��������Ķ�����Ԫ�أ���ԭ��������������X��������������W�ĵ���������4����Z��M������������ͬ��X��M�����ڱ��е�λ����ͼ��
W��X��Y��Z��M��Q��Ϊϡ��������Ķ�����Ԫ�أ���ԭ��������������X��������������W�ĵ���������4����Z��M������������ͬ��X��M�����ڱ��е�λ����ͼ��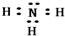 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HSO3-����Һ�з���ˮ�⣺HSO3-+H2O?SO32-+H3O+ | |
| B�� | ��Mg��OH��2��Һ�еμ�FeCl3��Һ���ɺ��ɫ������3OH-+Fe3+=Fe��OH��3�� | |
| C�� | ̼��������Һ�Լ��ԣ�HCO3-+H2O?H2CO3+OH- | |
| D�� | ���Ե缫���MgCl2��Һ��Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$OH-+Cl2��+H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com