
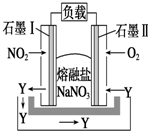
 熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )| A. | 石墨Ⅰ极为正极,石墨Ⅱ极为负极 | |
| B. | Y的化学式可能为NO | |
| C. | 石墨Ⅰ极的电极反应式为NO2+NO${\;}_{3}^{-}$-e-═N2O5 | |
| D. | 石墨Ⅱ极上发生氧化反应 |
分析 由图可知,石墨Ⅱ上氧气得到电子,则石墨Ⅱ为正极,石墨I上NO2失去电子,石墨I为负极,结合负极发生氧化反应、正极发生还原反应来解答.
解答 解:A.由图可知,石墨Ⅱ上氧气得到电子,则石墨Ⅱ为正极,石墨I上NO2失去电子,石墨I为负极,故A错误;
B.石墨I上NO2失去电子,N元素的化合价应从+4价升高,Y不可能为NO,故B错误;
C.石墨I上NO2失去电子,负极反应为NO2+NO3--e-═N2O5,故C正确;
D.石墨Ⅱ为正极,发生还原反应,故D错误;
故选C.
点评 本题考查原电池,为高频考点,把握图中物质的性质、电极判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意原电池原理的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向苯酚溶液中逐滴加入浓溴水,生成白色沉淀: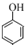 +3Br2→ +3Br2→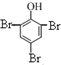 ↓+3HBr ↓+3HBr | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ | |
| C. | 向水杨酸(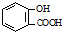 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: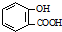 +2HCO3-→ +2HCO3-→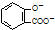 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向Ba(OH)2中加入H2SO4至中性:Ba2++OH-+SO42-+H+→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中气体密度的不随时间变化 | |
| B. | 容器中气体的平均相对分子质量不随时间变化 | |
| C. | 2VA(消耗)=VB(生成)时 | |
| D. | C和D的消耗速率相等时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl分散在无水酒精中,形成的分散系是胶体 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| C. | 胶体带电荷,而溶液呈电中性 | |
| D. | 在胶体中通电时,分散质微粒一定向某一极移动,在溶液中通电时,溶质微粒一定向两极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
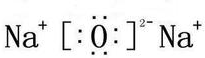 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其单质在常温下跟水的反应不如钠剧烈 | |
| B. | 其原子半径比钾离子半径小 | |
| C. | In是第5周期ⅠB族元素 | |
| D. | 其氢氧化物能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此法对环境不会造成任何污染 | |
| B. | 沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 | |
| C. | 若提取12 kg Mg,则电子转移1 000 mol | |
| D. | 以上提取镁的过程涉及的离子反应共有3个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com