

 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH 溶液、浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
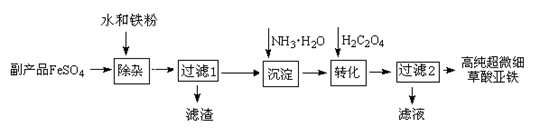
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验 | 除杂试剂 | 实验目的 |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 )如下:
)如下: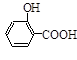 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑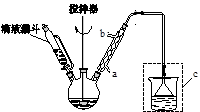
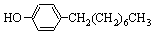 ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
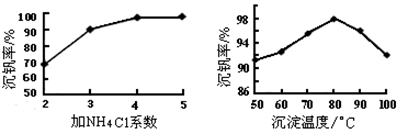
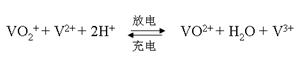
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com