
 =1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
=1mol,由方程式可知Fe2(SO4)3的物质的量为1mol, ×1mol=7mol,
×1mol=7mol,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、将少量NaOH固体加入热的浓NH4HSO3溶液中:NH4++OH-
| ||||
| B、CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+?Ca2++CO2↑+H2O | ||||
| C、向Fe2(SO4)3溶液中通入HI:2Fe3++2I-?2Fe2++I2 | ||||
| D、MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+?BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2通入品红溶液中,溶液退色 | B、新制氯水密闭放置一段时间后浅黄绿色消失 | C、向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | D、向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
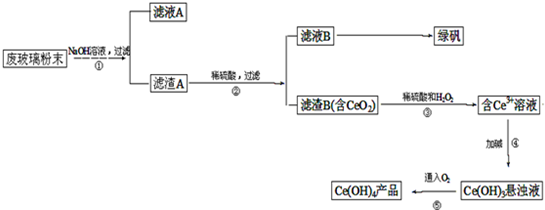
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com