
分析 (1)质量数=质子数+中子数,碘原子的质子数为53,据此计算碘131的原子核中的中子数与质子数之差;铯为碱金属元素,位于第六周期、ⅠA族;
(2)具有相同质子数的原子属于同一种元素;具有一定质子数和中子数的一种原子为一种核素;
(3)NH3D+中含有的质子数、中子数、电子数分别为11、8、10,据此进行解答.
解答 解:(1)碘131的原子核中,中子数为:131-53=78,质子数为53,碘131的中的中子数与质子数之差为:78-53=25;
铯属于碱金属元素,位于第六周期,所以铯在周期表中的位置为:第六周期IA族,
故答案为:25;第六周期IA族;
(2)${\;}_{6}^{12}$C、${\;}_{7}^{14}$N、${\;}_{1}^{2}$H、${\;}_{11}^{23}$Na、${\;}_{6}^{14}$C、${\;}_{92}^{235}$U、${\;}_{14}^{40}$K、${\;}_{53}^{131}$I、${\;}_{92}^{238}$U中,含有7种不同质子数,则含有7种元素;每一种原子都是一种核素,所以含有9种核素,
故答案为:7;9;
(3)在NH3D+中含有的质子数为:7+3+1=11,含有的中子数为:7+1=8,好一点电子数为7+3+1-1=10,则在NH3D+中,质子数、中子数、电子数之比为11:8:10,
故答案为:11:8:10.
点评 本题考查较为综合,涉及原子构成、核素与同位素、质量数与质子数、中子数之间的关系,题目难度中等,明确原子中质量数、质子数、中子数、电子数之间的关系为解答关键,注意掌握核素与同位素的概念,试题培养了学生的灵活应用能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2=CH2 | B. | 醋酸的分子式:CH3COOH | ||
| C. | 丙烷的比例模型: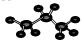 | D. | 乙酸甲酯的结构式:CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 沼气的利用,玉米制乙醇都涉及生物质能的利用 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | pH计可用于酸碱中和滴定终点和乙酸乙酯的水解程度的判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用水可以鉴别甲苯和四氯化碳 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 乙醇分子中不含有OH- | |
| D. | 95%的乙醇溶液常用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | V2 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com