
分析 (1)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱.HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,混合溶液中水电离的氢离子浓度为10-6mol/L;
(2)溶液混合得到等浓度的MOH、MCl混合溶液,混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性;
(4)若是等浓度,反应后生成HCN,溶液显示酸性;再根据电离常数公式求出HCN的电离常数;
(5)减缓反应速率,应降低浓度或降低反应温度,注意不影响生成氢气总量的要求.
解答 解:(1)HCl与MOH的物质的量相等,二者混合恰好反应得到MCl溶液,混合后溶液的pH=6,说明MOH为弱碱.
HCl溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度为$\frac{1{0}^{-14}}{0.2}$mol/L,混合溶液中水电离的氢离子浓度为10-6mol/L,则混合溶液中由水电离出的c(H+)>0.2mol/L HCl溶液中由水电离出的c(H+),
故答案为:>;
(2)溶液混合得到等浓度的MOH、MCl混合溶液,混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度,
故答案为:<;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性,则混合溶液的pH≤7,测得混合溶液的pH≠7,则混合溶液的pH=7,故答案为:<7;
(4)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性);HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=$\frac{a-0.01}{2}$(等体积混合,原浓度都减半)c(HCN)=$\frac{0.01}{2}$,带入公式,Ka=10-7•(a-0.01)/0.01=(100a-1)×10-7 mol•L-1,故答案为:(100a-1)×10-7 mol•L-1或(0.5a-0.005)×10-7/0.005 mol•L-1;
(5)A.加入碳酸钠,与硫酸反应,导致反应物浓度降低,反应速率减小,但硫酸物质的量减小,影响生成氢气的总量,故A错误;
B.加入醋酸钠溶液,生成弱电解质醋酸,溶液氢离子浓度减小,反应速率减小,但不影响生成氢气的总量,故B正确;
C.加入硫酸铜,发生置换反应,生成金属铜,金属锌被消耗,产生氢气的速率加快但是生成氢气的量会减少,故C错误;
D.加入硝酸,氢离子浓度增加,所以反应速率加快,但是硝酸和金属锌直间反应会产生一氧化氮,不会产生氢气,所以氢气的总量受影响,故D错误.
故选B.
点评 本题考查了酸碱混合的定性判断及有关pH的计算、影响化学反应速率的因素知识,(3)中注意HR为弱酸且酸过量,反应后的溶液显示酸性,不是根据生成强碱弱酸盐判断溶液显示碱性.


科目:高中化学 来源: 题型:选择题
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NO | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
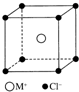 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )| A. | 6个 | B. | 8个 | C. | 12个 | D. | 16个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com