
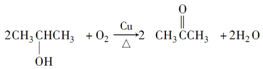

 .
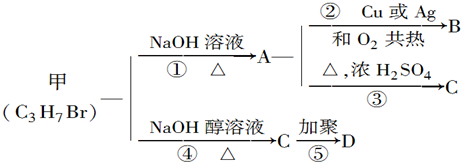
. 分析 甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成C为CH3CH=CH2,C发生加聚反应生成D的结构简式为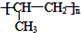 ,
,
1.甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO;
2.若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为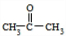 ,据此答题.
,据此答题.
解答 解:甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成C为CH3CH=CH2,C发生加聚反应生成D的结构简式为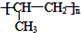 .
.
1.甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO.
(1)有机物甲的结构简式为CH3CH2CH2Br,
故答案为:CH3CH2CH2Br;
(2)甲→A的化学方程式为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr,
B和银氨溶液反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O,
故答案为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr;CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O;
2.若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为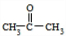 .
.
(1)A的结构简式为:CH3CH(OH)CH3,
故答案为:CH3CH(OH)CH3;
(2)反应②的方程式为: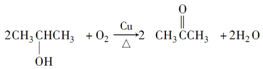 ,反应④的方程式为:
,反应④的方程式为: ,反应⑤的方程式为:
,反应⑤的方程式为: ,
,
故答案为: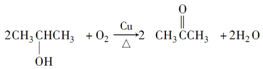 ;
; ;
; .
.
点评 本题考查了有机物的推断,关键是明确C3H7Br有2种同分异构体,再结合反应条件进行推断,熟练掌握有机物的官能团性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
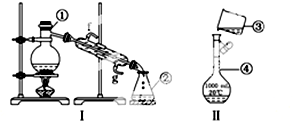
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-HCO3-?H++HCO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS-HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4-H2PO4-H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:S2-<Cl-<F- | B. | 稳定性:HF>HCl>H2S | ||
| C. | 碱性:KOH<NaOH<Al(OH)3 | D. | 还原性:K>Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
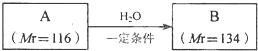
 ,
,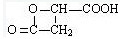 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一定体积醋酸溶液加水到原来体积的m倍,则pH增大m | |
| B. | 在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) | |
| C. | 25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等 | |
| D. | 25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)•c(OH-)=1×10-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com