
| A. | 在放电时,两极质量均增加 | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在放电时,负极发生的反应是 Pb+2e-+SO42-=PbSO4 | |
| D. | 在放电时,正极发生的反应是 PbSO4+2e-=Pb+SO42- |
分析 由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42-+2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动,以此解答该题.
解答 解:A.放电时形成原电池,两极上都生成PbSO4,质量都增加,故A正确;
B.由方程式可知,充电时,消耗水,生成硫酸,电解质溶液中硫酸浓度增大,故B错误;
C.放电时Pb为负极,负极发生方程式为Pb+SO42--2e-=PbSO4,故C错误
D.PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42-+2e-=2H2O+PbSO4,故D错误.
故选A.
点评 本题考查原电池和电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
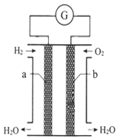 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2Cl在碱性溶液中水解 | |
| B. | CH2═CH-CH═CH2与H2按物质的量之比为1:1进行反应 | |
| C. | CH3CH═CH2与HCl加成 | |
| D. |  与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化过程中一定伴随着能量变化 | |
| B. | 放热反应可能需要加热才能进行 | |
| C. | 吸热反应只能在加热条件下才能进行 | |
| D. | 天然气在空气中燃烧时,能量转化形式不止一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 糖类、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解质溶液一定为强酸性 | |
| B. | 电子从a流出,经质子交换膜流向b | |
| C. | HS-在硫氧化菌作用下发生的反应为HS-+4H2O-8e-═SO42-+9H+ | |
| D. | 若该电池电路中有0.8mol电子发生转移,则有0.9molH+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol 则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol 则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com