
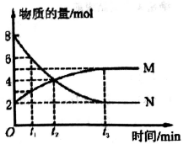
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠĶØČėĘųĢåMŗĶN²¢·¢Éś·“Ó¦£¬ĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠĶØČėĘųĢåMŗĶN²¢·¢Éś·“Ó¦£¬ĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | M”¢NÖ®¼ä×Ŗ»ÆµÄ·“Ó¦·½³ĢŹ½ĪŖM=2N | |
| B£® | t2Ź±æĢ£¬·“Ó¦“ļµ½Ę½ŗā£¬Õż”¢Äę·“Ó¦ĖŁĀŹ“ļµ½ĻąµČ | |
| C£® | t3Ź±æĢ£¬MµÄ·“Ó¦ĖŁĀŹĪŖ$\frac{3}{2{t}_{3}}$mol•L-1•min-l | |
| D£® | t1Ź±æĢ£¬ŌŚČŻĘ÷ÄŚĘųĢåMŗĶNµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1£ŗ2 |
·ÖĪö ÓÉĶ¼ĻóæÉÖŖt3Ź±“ļµ½Ę½ŗāדĢ¬£¬NĪŖ·“Ó¦Īļ£¬MĪŖÉś³ÉĪļ£¬ĒŅÓŠ”÷n£ØN£©£ŗ”÷n£ØM£©=£Ø8-2£©£ŗ£Ø5-2£©=6£ŗ3=2£ŗ1£¬Ōņ×Ŗ»ÆµÄ·“Ó¦·½³ĢŹ½ĪŖ2N=M£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗA£®ÓÉŅŌÉĻ·ÖĪöæÉÖŖ×Ŗ»ÆµÄ·“Ó¦·½³ĢŹ½ĪŖ2N=M£¬¹ŹA“ķĪó£»
B£®t2Ź±æĢ£¬·“Ó¦ĪļŗĶÉś³ÉĪļµÄĪļÖŹµÄĮæ±ä»Æ£¬Ć»ÓŠ“ļµ½Ę½ŗāדĢ¬£¬Õż”¢Äę·“Ó¦ĖŁĀŹ²»µČ£¬¹ŹB“ķĪó£»
C£®·“Ó¦ĖŁĀŹĪŖĘ½¾łĖŁĀŹ£¬²»ŹĒĖ²Ź±ĖŁĀŹ£¬¹ŹC“ķĪó£»
D£®Ģå»żĻąĶ¬£¬t1Ź±æĢ£¬ŌŚČŻĘ÷ÄŚĘųĢåMŗĶNµÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ6=1£ŗ2£¬ŌņĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1£ŗ2£¬¹ŹDÕżČ·£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāĶ¼”¢»ÆŃ§Ę½ŗāÓ°ĻģŅņĖŲ”¢Ę½ŗā¼ĘĖćµČ£¬ĪŖøßĘµæ¼µćŗĶ³£¼ūĢāŠĶ£¬²ąÖŲæ¼²éѧɜ¶ĮĶ¼»ńČ”ŠÅĻ¢ÄÜĮ¦ÓėÖŖŹ¶ĒØŅĘŌĖÓĆÄÜĮ¦£¬ĢāÄæÄѶČÖŠµČ£®


 ѧʌø“Ļ°Ņ»±¾ĶØѧĻ°×ܶÆŌ±ĘŚÄ©¼ÓŹī¼ŁŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ѧʌø“Ļ°Ņ»±¾ĶØѧĻ°×ܶÆŌ±ĘŚÄ©¼ÓŹī¼ŁŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø Ć¢¹ū½ĢøØŹī¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
Ć¢¹ū½ĢøØŹī¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŗĀČŗĶĀČĖ®¶¼ŗ¬ÓŠĀČĄė×Ó | |
| B£® | ĀČĘųŗĶŅŗĀȶ¼ÄÜŹ¹øÉŌļµÄÓŠÉ«²¼ĢõĶŹÉ« | |
| C£® | ŃĪĖįŗĶĀČĖ®¶¼ŗ¬ÓŠĀČĄė×Ó | |
| D£® | ŃĪĖįŗĶĀČĖ®¶¼ÄÜŹ¹ŹŖČóµÄÓŠÉ«²¼ĢõĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹÆÄ« | B£® | HCl | C£® | CO2 | D£® | BaCO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | lmolĘĻĢŃĢĒÄÜĖ®½āÉś³É2molCH3CH2OHŗĶ2molCO2 | |
| B£® | ±½µÄ½į¹¹¼ņŹ½ĪŖ £¬ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ« £¬ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ« | |
| C£® | ĻąĶ¬ĪļÖŹµÄĮæµÄŅŅĻ©ÓėŅŅ“¼·Ö±šŌŚ×ćĮæµÄO2ÖŠĶźČ«Č¼ÉÕ£¬ĻūŗÄO2µÄĪļÖŹµÄĮæĻąĶ¬ | |
| D£® | ŅŅĻ©ŗĶÖ²ĪļÓĶ¶¼ÄÜŹ¹äåĖ®ĶŹÉ«£¬ĘäĶŹÉ«ŌĄķ²»Ķ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijĪĀ¶ČĻĀ£¬pH=7µÄNH4ClÓėNH3•H2OµÄ»ģŗĻČÜŅŗ£ŗc£ØNH4+£©=c£ØCl-£©£¾c£ØH+£©=c£ØOH-£© | |
| B£® | 0.1 mol/L Na2SČÜŅŗ£ŗc£ØOH-£©=c£ØH+£©+c£ØHS-£©+c£ØH2S£© | |
| C£® | 25”ꏱ£¬pH=2µÄHCOOHÓėpH=12µÄNaOHµČĢå»ż»ģŗĻ£ŗc£ØHCOO-£©£¼c£ØNa+£© | |
| D£® | 0.1 mol/L Na2CO3ČÜŅŗÓė0.1 mol/L NaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£ŗ3c£ØCO32-£©+3c£ØHCO3-£©+3c£ØH2CO3£©=2c£ØNa+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com