
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①测得混合气体中CO2的浓度为0.3mol/L,若容器的体积为5L,所以平衡时二氧化碳的物质的量为:0.3×5=1.5mol,则一氧化碳的变化量为:1.5mol,反应经2min达平衡,则以CO浓度变化表示的反应速率为:$\frac{\frac{1.5}{5}mol/L}{2min}$=0.15mol/L•min,达平衡时CO的转化率为 $\frac{1.5}{3}×100%$=50%;
②若向达平衡的混合物中通入一定量的氦气,体积膨胀,相当于减小压强,则逆反应的速率减小,减小压强平衡,平衡不移动,容器中CO2的体积分数不变;③若对达平衡的混合物降温,混合气体的平均相对分子质量减小,说明平衡逆向移动,逆反应是放热反应,正反应是吸热反应;
④温度保持不变,平衡常数不变,根据平衡常数求解.
解答 解:(1)①某物质含量不变,说明各物质的量不变,反应达平衡状态,故正确;
②某物质转化率不变,说明各物质的量不变,反应达平衡状态,故正确;
③固体的浓度始终不变,故错误;
④恒容压强始终不变,故错误;
⑤条件一定,混合气体的平均相对分子质量不变,说明气体的质量不变,反应达平衡状态,故正确;
⑥体积一定时,混合气体的密度不再变化,说明气体的质量不变反应达平衡状态,故正确;
故选:③④;
(2)①测得混合气体中CO2的浓度为0.3mol/L,若容器的体积为5L,所以平衡时二氧化碳的物质的量为:0.3×5=1.5mol,则一氧化碳的变化量为:1.5mol,反应经2min达平衡,则以CO浓度变化表示的反应速率为:$\frac{\frac{1.5}{5}mol/L}{2min}$=0.15mol/L•min,达平衡时CO的转化率为 $\frac{1.5}{3}×100%$=50%,
故答案为:0.15mol/L•min;50%;
②若向达平衡的混合物中通入一定量的氦气,体积膨胀,相当于减小压强,则逆反应的速率减小,减小压强平衡,平衡不移动,容器中CO2的体积分数不变,
故答案为:减小;不变;
③若对达平衡的混合物降温,混合气体的平均相对分子质量减小,说明平衡逆向移动,逆反应是放热反应,正反应是吸热反应,故答案为:吸热;
③由①知:K=$\frac{0.{3}^{3}}{0.{3}^{3}}$=1,设体积为:V,则$(\frac{0.5}{\frac{4-0.5V}{V}})^{3}=1$,解之得:V=4L,故答案为:4.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含氯气和水分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是氯气 | |
| D. | 氯水放置数天后pH将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
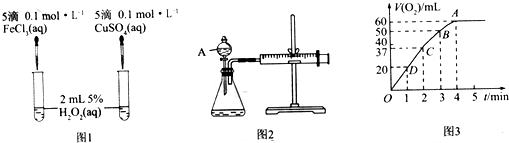
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述反应中生成的N2是火箭燃料燃烧后的氧化产物 | |
| B. | 推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体 | |
| C. | 火箭发射时看到的红棕色气体是火箭起飞后,保险活动门自动开启,排出部分高压氧化剂在空气中氧化的结果 | |
| D. | 从能量变化上看,上述反应是热能转化为动能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
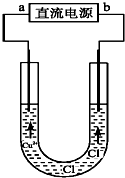
| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.4g | B. | 6.3g | C. | 7.2g | D. | 9.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
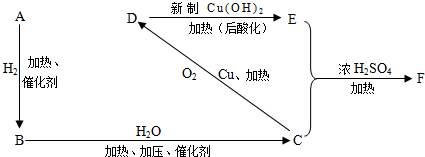
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫(俄国) | B. | 依马林(俄国) | ||
| C. | 别洛索夫(俄国) | D. | 马尔柯夫尼可夫(俄国) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com