
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
分析 (1)硫酸铝水解生成氢氧化铝和硫酸,硫酸是难挥发性的酸,溶液加热蒸干并灼烧,水挥出得到原物质;将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳;
(2)100mL 1mol•L-1的NaOH的物质的量=1mol/L×0.1L=0.1mol,标准状况下2.24LSO2的物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH=NaHSO3,溶液为亚硫酸氢钠溶液,亚硫酸氢根离子电离程度大于其水解程度;
(3)开始沉淀时pH小的离子先沉淀,溶度积常数越小的物质越先沉淀;0.3mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至降至10-5 mol•L-1),计算向溶液里加NaOH溶液,c(Cu2+)=10-5 mol•L-1,根据Ksp计算pH.
解答 解:(1)Al2(SO4)3溶液中,硫酸铝水解生成氢氧化铝和硫酸,Al2(SO4)3+6H2O?2Al(OH)3+3H2SO4,硫酸是难挥发性的酸,加热蒸干并灼烧最终得到物质是Al2(SO4)3,将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:
Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al2(SO4)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)100mL 1mol•L-1的NaOH的物质的量=1mol/L×0.1L=0.1mol,标准状况下2.24LSO2的物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH=NaHSO3,亚硫酸氢根离子水解小于亚硫酸氢根离子电离,溶液显酸性,故溶液中各离子浓度大小顺序是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2],0.3mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至降至10-5 mol•L-1),则应向溶液里加NaOH溶液,c(Cu2+)=10-5 mol•L-1,c(OH-)=$\sqrt{\frac{1×1{0}^{-20}}{1{0}^{-5}}}$=10-7.5mol/L,c(H+)=10-6.5mol/L,所以pH=6.5,
故答案为:Cu2+;6.5.
点评 本题考查了弱电解质的电离、盐的水解、离子浓度的比较、Ksp的应用等知识点,题目考查的知识点较多,题目难度中等,注意把握溶液中离子浓度大小比较的方法.


科目:高中化学 来源: 题型:选择题
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )| A. | 分子B中只含有3种官能团 | |
| B. | 分子A中所有碳原子不可能位于同一平面 | |
| C. | 分子B能发生银镜反应,但不能发生水解反应 | |
| D. | 用FeCl3溶液可检验物质B中是否混有A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2YZ | B. | X2YZ2 | C. | X2YZ3 | D. | X2YZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 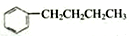 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可用于实验室制备少量Cl2或NH3 | |
| B. | 可用从a处加水的方法检验装置②的气密性 | |
| C. | 实验室也可以用装置③收集HCl气体 | |
| D. | 装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨和温室效应都与化石燃料的使用有关 | |
| B. | 水体富营养化主要是因为水中含有较多的碳、氮等元素 | |
| C. | 天然气水合物,又称可燃冰,其主要可燃成分是氢气 | |
| D. | 聚酯纤维和光导纤维都是有机高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com