
氯化亚砜(SOCl2,结构式如图)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2=SOCl2+SO2,
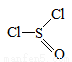
下列有关说法正确的是
A.SCl2和SOCl2中S的化合价分别为+2、+4价
B.制备反应中,二氧化硫是氧化产物
C.每消耗1mol SCl2,转移1mol电子
D.SOCl2分子中既含有离子键又含有共价键
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:实验题
(10分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)装置中干燥管B的作用是_____________________________________。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(3)步骤⑤的目的是________________________________________。
(4)步骤⑦的目的是_______________________________________________。
(5)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
“化学与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
A.放电时,负极质量增加
B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接
C.放电时,正极反应为:
D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(16分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式____;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为___________________、__________________。
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(5)向含1molFeBr2的溶液中通入______L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+。(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有______(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:填空题
(18分)通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。
(1)如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。按要求回答问题:
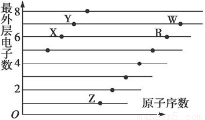
①Y元素在元素周期表中的位置为__________。
②气态氢化物的稳定性:X_____(填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______(填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为_____________。
(2)X、Y、Z三种物质有以下转化关系:
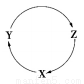
①如果三种物质中均含Mg元素,且X为镁单质,则Y、Z可能是_____、_______(填化学式,只填一种物质即可,下同);
②如果三种物质中均含Cl元素,且X为Cl2,则Y、Z可能是_____、______;
③如果三种物质中均含Si元素,且X为SiO2,则Y、Z可能是_____、______。
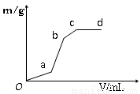
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,生成沉淀质量m与Ba(OH)2体积V之间的关系,则oa段生成的沉淀为____(填化学式,下同),ab段生成的沉淀为_____;bc段生成的沉淀为_________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)
A.1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解)
B.1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子
C.在该溶液中,K+、NH4+、I-、SO42-可以大量共存
D.与Cu反应的离子方程式为:Fe3++Cu = Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列有关说法中不正确的是
A.标准状况下,22.4 L氦气含有NA个氦原子
B.20 g重水含有10 NA个电子
C.12.5 mL l6 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列是关于氯水的叙述,正确的是
A.新制氯水中只含C12和HClO分子B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2D.氯水放置数天后,pH值将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com