
| A. | 点燃的酒精灯不小心打翻了,应立即用自来水灭火 | |
| B. | 皮肤沾上少量浓硫酸后,可先用大量水冲洗,再涂上稀碳酸氢钠溶液 | |
| C. | 在蒸馏实验中,加热一段时间后,忘了加入沸石,打开瓶塞立即加入沸石 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞塞住顶端出口 |
分析 A.酒精灯不慎打翻起火,应用湿抹布盖灭;
B.浓硫酸溶于水并放热,且具有强腐蚀性;
C.立即加入沸石会引起爆沸;
D.有机物能将橡胶塞腐蚀.
解答 解:A.酒精灯不慎打翻起火,应用湿抹布盖灭,即可以降温,又可隔绝空气,故A错误;
B.浓硫酸溶于水并放热,且具有强腐蚀性,少量浓硫酸沾在皮肤上,应先用干抹布拭去,再用大量的水冲洗,最后涂上碳酸氢钠溶液,故B正确;
C.立即加入沸石会引起爆沸,应冷却后再加入,故C错误;
D.有机物能将橡胶塞腐蚀,应用玻璃塞,故D错误.
故选B.
点评 本题考查了化学实验中的安全及事故处理知识,题目难度不大,旨在考查学生的基础知识的掌握,化学实验是化学的基础,要了解常见的实验操作,能对错误操作的后果做出判断,养成良好的实验习惯.


科目:高中化学 来源: 题型:解答题
 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
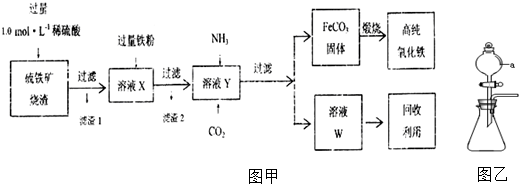
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 三氧化二铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铝与氢氧化钠溶液反应:2AI+2OH-═2 AIO2-+H2↑ | |
| D. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
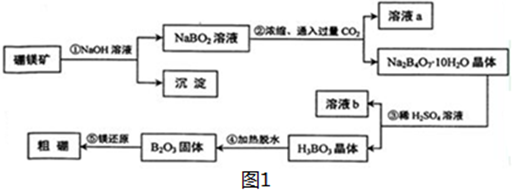
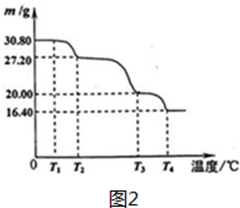
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com