
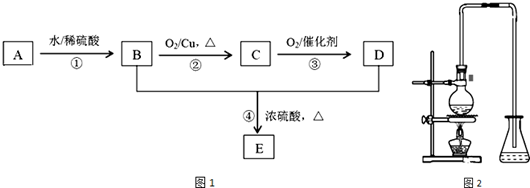
分析 A是一种植物生长的调节剂,分子式为C2H4,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步氧化生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,以此解答该题.
解答 解:A是一种植物生长的调节剂,分子式为C2H4,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步氧化生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3.
(1)A的结构简式为CH2=CH2,B为CH3CH2OH,所含官能团为:羟基,故答案为:CH2=CH2;羟基;
(2)反应①为加成反应,反应④为取代反应,故答案为:加成反应;取代反应;
(3)反应②的化学方程式为:2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2 H2O,
故答案为:2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2 H2O;
(4)E的名称为:乙酸乙酯.实验室由反应④制备E的装置如图2烧瓶中加入碎瓷片的作用是:防止暴沸,长导管的作用是导气和冷凝、回流,锥形瓶中盛放的液体是饱和Na2CO3溶液,
故答案为:乙酸乙酯;防止暴沸;冷凝、回流;饱和Na2CO3溶液.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,题目比较基础,涉及酯、醇、醛、羧酸性质,注意对基础知识的理解掌握.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2C(OH)(CH3)2 | B. | (CH3)2 CHOH | C. | CH3CH(OH)CH2CH3 | D. | 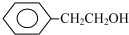 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ①②⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.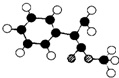 (图中球与球之间连线表示单键或双键).
(图中球与球之间连线表示单键或双键).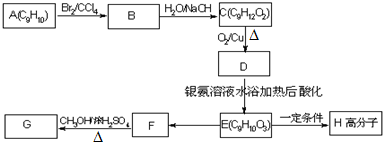
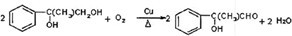 .E→H
.E→H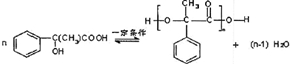 .
.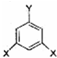 (其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式
(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式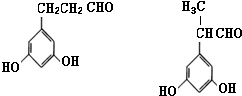 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
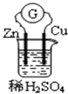
| A. | 该装置将化学能转化为电能 | B. | Zn是负极,发生还原反应 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 铜片上发生的反应为 2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和二甲醚的分子式相同,结构不同 | |
| B. | 乙醇和二甲醚的物理性质不同,化学性质相同 | |
| C. | 二者完全燃烧后的产物相同 | |
| D. | 1mol二甲醚分子中含有8NA共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
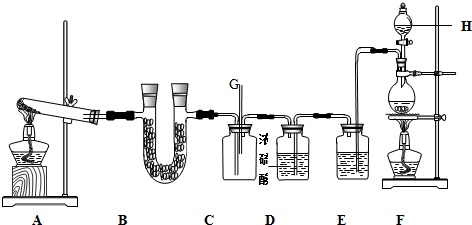
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→Ca(OH)2+C2H2↑ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
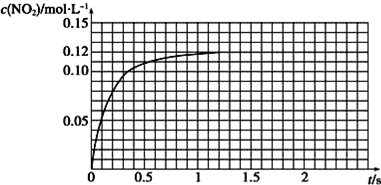
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com