
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
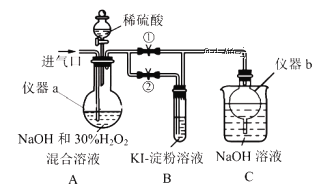
Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为______________,仪器b的作用是______________。
(2)装置A中生成NaClO2的离子方程式为____________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、_____、_____、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________。
(5)B中现象为_________________ 。产生该现象的离子方程式为___________________。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,__________________________________。
【答案】烧瓶(圆底烧瓶) 防止倒吸 2ClO2+2OH-+H2O2=2ClO2-+H2O+O2↑ 降温结晶 过滤 NaClO2与H2SO4反应生成的Cl-对反应起催化作用 溶液变蓝色 2ClO2+10I-+8H+=2Cl-+5I2+4H2O 从进气口通入一段时间的空气
【解析】
( 1 )根据仪器a的特点,仪器a为圆底烧瓶,仪器b为干燥管,因此仪器b的作用是防止倒吸;
(2 )根据实验步骤,装置A中加入NaOH、H2O2和ClO2 ,产物是NaClO2 ,Cl的化合价降低,即ClO2作氧化剂,H2O2作还原剂, H2O2的氧化产物是O2,因此有ClO2 + H2O2+OH-→ClO2 - +O2↑ + H2O,根据化合价升降法进行配平,得出仪器A中发生离子反应方程式为2ClO2+ 2OH- +H2O2=2ClO2- +H2O+O2↑;
(3)蒸发浓缩、降温结晶,得到NaClO2固体,然后过滤、洗涤、干燥;
(4) NaClO2在酸性条件下能生成NaCl和ClO2,发生的反应是5NaClO2 + 2H2SO4=NaCl+ 4ClO2↑+ 2H2O + 2Na2SO4 ,开始时A中反应缓慢,稍后产生气体的速率急剧加快的原因可能是NaClO2与H2SO4反应生成的Cl-对反应起催化作用;
( 5) ClO2的性质与氯相似,即ClO2的氧化性强于I2,ClO2把I -氧化成I2,淀粉遇碘单质变蓝,即B中现象是溶液变蓝色;
(6) 为了让有毒气体完全被吸收,在进气口通入一段时间的空气。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小 Fe> > > 。_________
(2)铝原子最外层电子排布式为_____,核外共有_____种不同运动状态的电子。
(3)实验室制备氯化氢气体的反应:_____。其制备装置和实验室制备_气体类似(填化学式)。
(4)16g 硫磺在过量氧气中燃烧放出 149kJ 的热量,写出该热化学方程式______________。
(5)比较两种化合物熔点高低,氯化钠_____氧化镁,请解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是
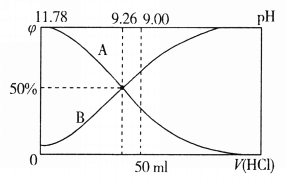
A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
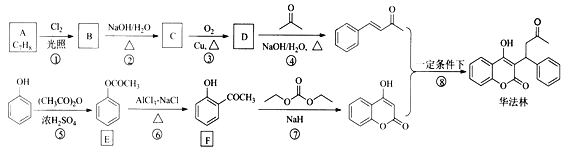
回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2某同学设计从孔雀石中冶炼铜的方案如下:
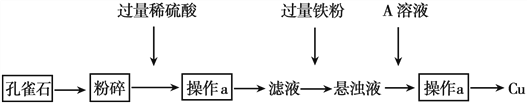
回答下列问题:
(1)将孔雀石粉碎的目的是_________,加入过量稀硫酸,可观察到的现象是_________
(2)操作a的名称是________,在滤液中加入过量铁粉发生的反应有_______________(用离子方程式表示)
(3)A的化学式为_________,在悬浊液中加入A的目的是___________
(4)从滤液中获得铜的另外一种方案是:2CuSO4+ 2H2O![]() 2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
(5)请你根据提供的试剂,设计由孔雀石冶炼铜的另外一种方案(请用简洁的文字说明)__________(可供选择试剂:铁粉稀硫酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
(1)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有___________种。基态Ti2+的最外层电子排布式为______________________。
(2)铝的逐级电离能数据为:I1=580kJ/mol、I2=1820 kJ/mol、I3=2750 kJ/mol、I4=11600kJ/mol。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在___________之间(用I1、I2、I3……等填空)
(3)已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是___________(填化学式),理由是___________。
(4)催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。

①M中,碳原子的杂化类型有___________。
②M中,不含___________(填标号)
A.π键 B.σ键 C.配位键 D.氢键 E.离子键
(5)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AIH4-空间构型相同的一种分子___________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有___________个:NaAlH4晶体的密度为___________g/cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com