
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种
阳离子 | H+、Na+、Al3+、Fe3+、NH4+、Mg2+ |
阴离子 | OH-、CO32-、SiO32-、AlO2-、Cl- |
现取适量该溶液,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示:
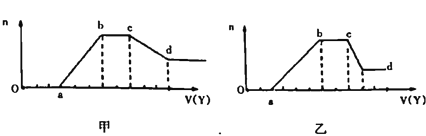
(1)若Y是盐酸,所得到的关系图如甲图所示,则X中一定含有的阴离子是______,X中一定存在的几种阴离子物质的量之比为____(按题干表格中阴离子出现的顺序写比例顺序);ab段发生反应的离子方程式为_________________;cd段发生的反应的离子方程式为______________。
(2)若Y是NaOH溶液,所得到的关系图如乙用所示,X中一定含有的阳离子是_______;ab段发生反应的离子________________;bc段发生反应的离子为________________;cd段发生反应的离子方程式为______________。
【答案】 OH-、CO32-、SiO32-、AlO2- 3:1:1:1 SiO32-+2H+=H2SiO3↓ AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=AlO2-+2H2O H+、Al3+、NH4+、Mg2+ Al3+、Mg2+ NH4+ Al(OH)3+OH-===AlO2-+2H2O
【解析】(1)无色稀溶液X中不会含有Fe3+,加入盐酸后没有立即产生沉淀,说明含有OH-。沉淀达到最大值后不再发生变化,说明溶液中含有CO32-。然后沉淀开始减少,但没有完全消失,说明形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,所以溶液中一定存在SiO32-、AlO2-,根据以上分析可知一定不能大量存在H+、Al3+、Mg2+、NH4+,根据电荷守恒可知一定存在Na+。根据图像可知消耗氢氧根需要3体积盐酸,产生沉淀需要3体积盐酸,与碳酸根反应需要2体积盐酸,溶解氢氧化铝需要3体积盐酸,则产生氢氧化铝沉淀需要1体积盐酸,因此产生硅酸沉淀需要1体积盐酸,所以OH-、AlO2-、SiO32-、CO32-物质的量之比为3:1:1:1;ab段发生反应的离子方程式为SiO32-+2H+=H2SiO3↓、AlO2-+H++H2O=Al(OH)3↓;cd段发生的反应的离子方程式为Al(OH)3+3H+=AlO2-+2H2O。(2)无色稀溶液X中不会含有Fe3+,若Y是NaOH溶液,加入氢氧化钠后不立即产生沉淀,说明含有H+,所以不能大量存在氢氧根。沉淀达到最大值后不再发生变化,说明还含有NH4+。继续加入氢氧化钠沉淀开始减少,但不能完全溶解,说明沉淀是氢氧化铝和氢氧化镁,即一定含有Al3+、Mg2+,所以CO32-、SiO32-、AlO2-一定不能存在,根据溶液显电中性可知Cl-一定存在。根据以上分析可知ab段发生反应的离子为Al3+、Mg2+;bc段发生反应的离子为NH4+;cd段发生反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】已知异丙苯的结构简式如图,下列说法错误的是( ) ![]()
A.异丙苯的分子式为C9H12
B.异丙苯的沸点比苯高
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯和苯为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
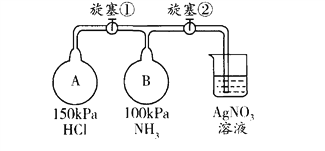
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究 氨气的性质。

(1)关闭装置I中的止水夹,向分液漏斗中加入适量水,打开活塞,说明装置I 气密性良好的现象是____________________________________________________。
(2)利用装置I制取氨气,应选用的试剂为浓氨水_______ 和 ______(填序号)。
A.氢氯化钠 B.浓硫酸 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接_____, 接 , 接 。
(4)将氨气通入盛有氧化铜粉末的玻璃管中,加热有红色固体和无色气体单质生成,证明氨气具有_____________性,反应的化学方程式是__________________________________。
(5)收集氨气,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______________________ (用化学方程式表示);稳定后,关闭旋塞①,再打幵旋塞②,B瓶中的现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4 , 其过程如下: I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.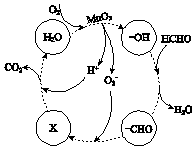
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4 , 该反应的化学方程式是 .
(2)II 中加入MnO2的主要目的是;调溶液 pH=4.7,生成的沉淀主要含有 和少量CaSO4 .
(3)III中加入阳离子吸附剂,主要除去的离子是 .
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2 . ①电解MnSO4溶液的离子方程式是
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是 , 总反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HCl(aq)、Al(OH)3、NaOH(aq)、Al、Cl2、Al2O3六种物质,它们之间的关系如图所示,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是
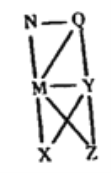
A. M一定为NaOH(aq) B. Z可能为Al2O3
C. N可能为Cl2、Al、Al2O3、Al(OH)3中的一种 D. Y一定是HCl(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性实验小组欲验证浓硝酸在与Cu、Ag 合金的反应过程中除生成NO2气体外,还会有少量NO生成。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装器。

请回答下列问题
(1)写出A中银与HNO3反应时所有可能的离子方程式_____________________。
(2)实验开始时,打开分液漏斗前要先打开活塞______( 填“K1”或“K2”),其目的是___________。
(3)装置中B瓶选用的试剂______________。
a.H2O b.浓硫酸 c.NaOH 熔液
(4)装置E中长颈漏斗的作用____________。
(5)反应停止后,欲想证明有NO生成,需要怎样操作:__________,当出现何种现象说明有NO生成____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1-2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀.请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_________。
(2)本实验用到的基本仪器已有烧杯、天平托盘(带砝码、镊子)、玻璃棒,还缺少的仪器是_____、____、____。
(3)下列情况会使所配溶液浓度偏高的是(填序号)________。
a.某同学观察液面的情况如右图所示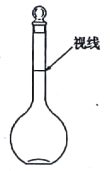
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com