
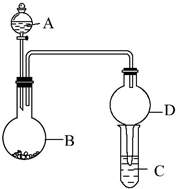
 用如图所示装置进行实验(夹持装置已略去).请回答下列问题:
用如图所示装置进行实验(夹持装置已略去).请回答下列问题:分析 (1)若A中为浓硫酸,B中为铁单质,铁遇到浓硫酸会发生钝化,不能继续反应,铁为26号元素,有四个电子层,最外层2个电子,据此书写基态铁原子核外电子排布式;
(2)B中发生Cu与浓硝酸的反应,生成硝酸铜、NO和水;
(3)若A中为浓氨水,B中为生石灰,为固液反应制取氨气原理,生成的氨气与C中铝离子反应生成沉淀;
①生成的氨气的原理为CaO+H2O=Ca(OH)2、消耗水并放热,且NH3+H2O?NH3.H2O?NH4++OH-,平衡逆向移动,据此分析固体的成分;
②通入过量氨气,生成氢氧化铝和硫酸铵;
(3)若A中为稀盐酸,B中为碳酸钙,将稀盐酸滴入B中后发生反应生成二氧化碳气体,通过C中为NaAlO2溶液反应生成氢氧化铝沉淀;
解答 解:(1)若A中为浓硫酸,B中为铁单质,铁遇到浓硫酸会发生钝化,不能继续反应,铁为26号元素,有四个电子层,最外层2个电子,位于周期表中的第四周期第VIII族,据此书写基态铁原子核外电子排布式为:[Ar]3d64s2 ,
故答案为:钝化;第四周期第VIII族;[Ar]3d64s2 ;
(2)B中发生Cu与浓硝酸的反应,生成硝酸铜、NO和水,该反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)若A中为浓氨水,B中为生石灰,为固液反应制取氨气原理,生成的氨气与C中铝离子反应生成沉淀;
①由生成的氨气的原理为CaO+H2O=Ca(OH)2、消耗水并放热,且NH3+H2O?NH3.H2O?NH4++OH-可知,氢氧根离子浓度增大平衡逆向移动,使氨气逸出,且温度升高,降低氨气的溶解度,使氨气逸出,
a.CaO溶于水放热,氨气挥出,故a正确;
b.NaOH固体溶解过程中放热,氨气挥出,故b正确;
c.NaCl 溶解过程中温度变化不大,不能放出氨气,故c错误;
d.P2O5和氨水反应不能放出氨气,故d错误;
故答案为:ab;
②通入过量氨气,生成氢氧化铝和硫酸铵,离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)A若A中为稀盐酸,B中为碳酸钙,将稀盐酸滴入B中后发生反应生成二氧化碳气体,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,通过C中为NaAlO2溶液反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O; AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
点评 本题考查较为综合,涉及常见气体的制备以及性质探究,把握发生的氧化还原反应原理为解答的关键,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握图中装置及反应原理、对应物质的性质等分析解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | 若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | X使蔗糖变黑的现象主要体现了X的脱水性 | |
| D. | 工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
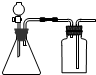
| A. | 将双氧水(H2O2)滴到MnO2中制取O2 | B. | 将浓盐酸滴到浓硫酸中制取HCl | ||
| C. | 将浓氨水滴到生石灰(CaO)中制取NH3 | D. | 将稀硫酸滴到锌粒上中制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | Y的单质能将X从NaX的溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com