
| A. | 1mol NH3中含有3NA个N-H键 | |
| B. | 36g C60含分子数为0.05NA | |
| C. | 标准状况下,11.2L CO2中含有2NA个共用电子对 | |
| D. | 18g重水(${\;}_{1}^{2}$H2O)中含有10NA个电子 |
分析 A.1个氨气分子中含有3个N-H键;
B.C60相对分子量:720,计算36g的物质的量;
C.1个二氧化碳分子含有4对共用电子对;
D.重水分子中含有10个电子,其摩尔质量为20g/mol;
解答 解:A.1个氨气分子中含有3个N-H键,1mol NH3中含有3NA个N-H键,故A正确;
B.36g C60含分子数=$\frac{36g}{720g/mol}$×NA=0.05NA,故B正确;
C.标准状况下,11.2L CO2中含有共用电子对=$\frac{11.2L}{22.4L/mol}$×4×NA=2NA,故C正确;
D.18g重水的物质的量为:$\frac{18g}{20g/mol}$=0.9mol,0.9mol重水中含有9mol电子,含有9NA个电子,故D错误;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
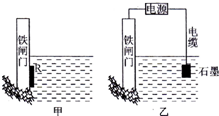 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 金属 | 酸溶液的浓度和体积 | 温度/℃ |
| A | 2.4 g 锌片 | 3 mol•L -1硫酸50 mL | 40 |
| B | 2.4 g锌粉 | 1 mol•L-1硫酸200 mL | 30 |
| C | 2.4 g锌粉 | 3 mol•L-1硫酸50 mL | 40 |
| D | 5.6 g锌片 | 3 mol•L-1硫酸1 00 mL | 30 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物YZ3极易溶解于水 | |
| B. | Z与M可以形成共价化合物 | |
| C. | 12g14X中含有质子的物质的量为6mol | |
| D. | 由上述四种元素组成的离子化合物受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
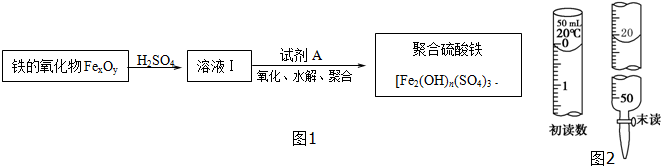
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com