
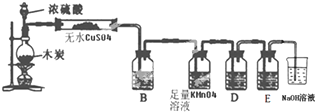
分析 (1)浓硫酸和木炭粉在加热条件下发生反应生成二氧化碳、二氧化硫和水;
(2)验证生成产物应先验证水蒸气的存在,再验证二氧化硫存在,除去二氧化硫,验证二氧化硫是否除净,最后验证二氧化碳的存在;
(3)根据n=$\frac{m}{M}$计算出碳的物质的量,再根据反应方程式计算出生成二氧化硫的物质的量,最后根据V=nVm计算出标况下二氧化硫的体积.
解答 解:(1)浓硫酸和木炭粉在加热条件下发生反应生成二氧化碳、二氧化硫和水,反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2H2O+2SO2↑,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2H2O+2SO2↑;
(2)验证生成产物应先利用无水硫酸铜验证水蒸气的存在,遇到水变蓝证明生成水;再利用品红溶液验证二氧化硫存在,通过装置B中的品红溶液褪色证明生成二氧化硫的生成,
故答案为:品红;检验SO2;
(3)1.2g碳的物质的量为:$\frac{1.2g}{12g/mol}$=0.1mol,根据反应2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2H2O+2SO2↑可知,0.1mol碳完全反应会生成0.2mol二氧化硫,标况下0.2mol二氧化硫的体积为:22.4L/mol×0.2mol=4.48L,
故答案为:4.48.
点评 本题考查了浓硫酸的性质的实验设计和性质分析判断,题目难度中等,产物的实验验证方法和试剂选择是解题关键,注意掌握浓硫酸的性质,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 电离能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 | |
| B. | 三种元素中,Y元素的第一电离能最大,其电负性也最大 | |
| C. | 等物质的量的X、Y、Z三种单质与少量盐酸反应时放出的氢气的物质的量之比为1:1:1 | |
| D. | 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(A-)>c(H+)>c(OH-) | B. | c(A-)+c(HA)=0.05mol•L-1 | ||
| C. | c(Na+)>c(A-)>c(HA)>c(OH-) | D. | c(HA)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小 | |
| B. | 石蕊、酚酞等酸碱指示剂均可用作中和滴定的指示剂 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾具有强还原性,可用其余TiCl溶液反应制取金属Ti | |
| B. | 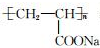 表示一种易溶于水的高分子树脂 表示一种易溶于水的高分子树脂 | |
| C. | 由于Si是一种很重要的半导体材料,故常用其来制作信息的传到材料-光导纤维 | |
| D. | 山东东营广饶县一男子子收到网购物品后,因吸人氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构简式为FCH2COOCH3能与H2发生加成反应.也能被LiAlH4还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com