
【题目】下列有关容量瓶的四种说法,正确的一组是
①标有使用温度、容积和一条刻度线;
②不宜贮存溶液;
③不能用来加热,不能作反应器;
④使用之前要检查是否漏水;
⑤容量瓶用蒸馏水洗净后,应干燥后再配制溶液。
A. 仅①②③④ B. 仅②③ C. 仅①②④⑤ D. 仅②③④
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
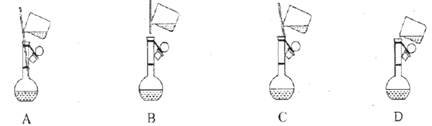
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO能否与Na2O2反应以及反应后的产物,该小小组同学设计了如图所示装置(夹持仪器、连接用的乳胶管均已省略)。

经査阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式:________________。
(2)为了完成实验,选择上图中的装置,其连接顺序为a→_______(按气流方向,用小写字母表示);有同学认为该装置存在缺陷,则该缺陷是______________。
(3)连接好仪器,_____________,装入药品后,要通入一段时间的氮气,在滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是_______________。
(4)装置E的作用是________________;能说明NO与Na2O2发生反应的实验现象是_____________。
(5)探充NO与Na2O2反应的产物。
假设1:产物只有NaNO3;假设2:_________________;
假设3:产物为NaNO3和NaNO2的混合物。
为验证反应产物,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为___________________,反应产物中NaNO2的质量分数为_____(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应:①2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) △H=﹣2600 kJ/mol
4CO2(g)+2H2O(l) △H=﹣2600 kJ/mol
②2CO(g)+O2(g)![]() 2CO2(g) △H=﹣566 kJ/mol
2CO2(g) △H=﹣566 kJ/mol
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=﹣49.0 kJ/mol
CH3OH(g)+H2O(g) △H=﹣49.0 kJ/mol
下列叙述正确的是
A. 根据方程式②,CO的燃烧热为566 kJ/mol
B. 在③反应时,若加入催化剂,可以使△H减小
C. 若投入1molCO2和3molH2在一定条件下充分反应,则放出热量49.0 kJ
D. 若生成相同质量的CO2,则放出的热量C2H2大于CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) ![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色。
往上述溶液中加入氢氧化钠溶液呈_______色,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压强或温度),平衡就会向着_________这种改变的方向移动;
(2)在KMnO4与H2C2O4反应中,可通过测定_________________的时间来测定该反应的速率;
此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)。
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①淀粉溶液的作用是__________________________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,
试推测该实验结论: ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单、双键交替结构,下列可以作为证据的事实是( )
![]() 苯不能使酸性高锰酸钾溶液褪色
苯不能使酸性高锰酸钾溶液褪色
![]() 苯中所有碳碳键的键长均相等
苯中所有碳碳键的键长均相等
![]() 苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
![]() 经实验测得邻二甲苯只有一种结构
经实验测得邻二甲苯只有一种结构
![]() 苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO—和Cl—,在75℃以上和浓碱溶液中主要产物是ClO3—和Cl—。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。回答下列问题:
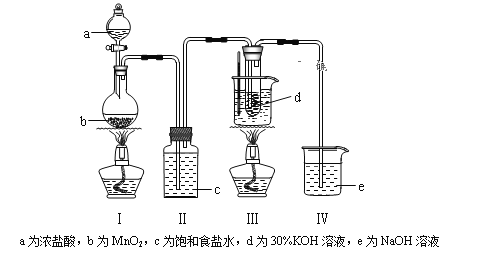
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
①写出装置Ⅰ中反应的化学方程式为____________________________。
②若取消装置Ⅱ,对本实验的影响是____________________________。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是_______。
(2)已知碱性条件下,ClO—有强氧化性,而ClO3—氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO—氧化,而不能被ClO3—氧化。_________________。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3—+6I—+6H+=Cl—+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O32—+I2=S4O62—+2I—)
①步骤2的目的是________。写出煮沸时反应的化学方程式________。
②样品中KClO3的质量分数为________。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学设计如图所示装置探究氯气能否与水发生反应。气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
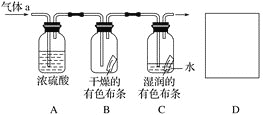
(1) 浓硫酸的作用是_____________________________。
(2) 证明氯气和水发生反应的实验现象为_________________________。
(3) 该实验设计存在的缺陷是____________________,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_________________________。
II.如图为浓硫酸与铜反应及其产物检验的实验装置
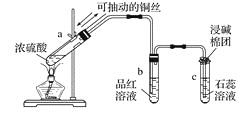
回答下列问题:
(1) 指出试管b、c中产生的实验现象:b中___________________;c中______________________。
(2) 反应结束后试管a中有部分白色固体,将a试管中的溶液慢慢倒入水中,发生的变化是___________。
(3) 写出浓硫酸与铜反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2 L的密闭容器中,A、B的物质的量随时间变化的曲线如图所示,请据图回答下列问题:
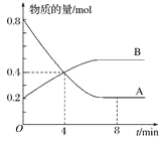
(1)该反应的化学方程式为_______________。
(2)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上填“>”、“<”或“=”)。
(3)反应开始至4 min时,A的平均反应速率为_______________________。
(4)4 min时,反应是否达到平衡状态?________(填“是”或“否”)。8 min时,υ(正)________(填“>”、“<”或“=”)υ(逆)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com