
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
分析 A.根据漂白粉的性质及HClO的性质来分析漂白粉需要密封保存;
B.光导纤维的主要成分是二氧化硅;
C.氯化铁可与铜发生氧化还原反应,可用于刻蚀印刷电路板,但氢氟酸蚀刻玻璃不属于氧化还原反应;
D.氧气、臭氧属于两种物质,相互间的转化为化学变化.
解答 解:A.因碳酸的酸性大于次氯酸,则Ca(ClO)2能和空气中CO2、H2O发生反应生成HClO,且HClO光照或受热会发生分解,则漂白粉需要密封避光保存于阴凉处,故A正确;
B.光导纤维的主要成分是二氧化硅,而将太阳能转化为电能的常用材料即硅太阳能电池板的成分是单质硅,故B错误;
C.工业上用FeCl3溶液刻蚀铜的线路板,反应为Cu+2FeCl3=CuCl2+2FeCl2,该反应为氧化还原反应,玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,该反应不属于氧化还原反应,故C错误;
D.家用消毒柜常用臭氧(O3)消毒,在消毒过程中通过放电发生如下反应:3O2=2O3,这一过程属于化学变化,故D错误;
故选A.
点评 本题考查了元素化合物有关知识,掌握常见物质的成分是解答关键,侧重硅、氯、性质的考查,注意的是光导纤维的主要成分是二氧化硅,硅太阳能电池板的成分是单质硅,同素异形体间的转化为化学变化,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
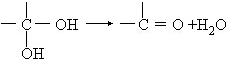
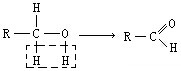
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
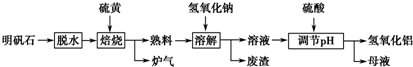
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
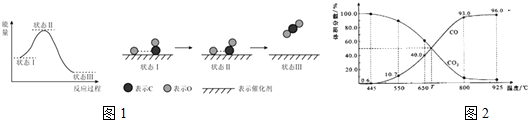
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纤维素的物质可以制造酒精 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com