
 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.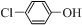 )的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为
)的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.  全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 将少两KCl晶体加人到如下反应体系中:FeCl3+3KSN?Fe(SCN)3+3KC1 | 证明浓度的改变可导致平衡移动 |
| B | 向某品牌的食盐水中加人几滴淀粉试液 | 确定该品牌食盐是否为加碘盐 |
| C | 将KMnO4溶液加人到丙烯醇(CH2=CHCH2OH)中 | 验证KMnO4能氧化一OH |
| D | 在两支试管中各加人2mL5%H2O2溶液,洱分別滴人0.1mol/L.FeCl3 和CuSO4溶液液各 1ml. | 研究不同催化剂对H2O2分解速率的催化效率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是研究甲烷取代反应实验装置图,具体的实验方法是:
如图是研究甲烷取代反应实验装置图,具体的实验方法是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com