
| A. | x=2.25 y=4.74% | B. | x=5 y=11.11% | ||
| C. | x=5 y=10% | D. | x=2.875 y=5.75% |
分析 分别根据n=$\frac{m}{M}$计算出 氢氧化钠、水的物质的量,根据N=nNA可知,钠离子与水的分子数之比=物质的量之比,据此列式计算出x;根据溶质质量分数ω$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%列式计算y.
解答 解:xg氢氧化钠的物质的量为:$\frac{xg}{40g/mol}$=$\frac{x}{40}$mol,45g水的物质的量为:$\frac{45g}{18g/mol}$=$\frac{5}{2}$mol,
每20个水分子中溶有1个Na+,根据N=nNA可知,钠离子与水的分子数之比=物质的量之比,
即:$\frac{x}{40}$mol:$\frac{5}{2}$mol=1:20,
解得:x=5;
5g氢氧化钠溶解与45g水中,所得溶液的质量分数为:y=$\frac{5g}{5g+45g}$×100%=10%,
故选C.
点评 本题考查了混合物反应的计算、溶质质量分数的计算,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) | |
| B. | 新制氯水使红色布条褪色(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 金刚石、石墨与O2反应,均可生成具有极性共价键的CO2 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)═C(石墨,s)△H=E3-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
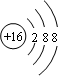 ;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 | |
| B. | 39g化合物Z2Y2与X2Y反应转移电子数约为6.02×1023 | |
| C. | 元素Y、R分别与元素X形成的倾听合物的热稳定性:XmY>XmR | |
| D. | 元素Z、R的氧化物的水化物相互反应生成的盐呈中性或碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com