
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ②③④ |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
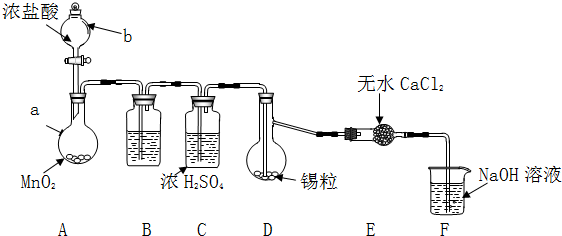
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
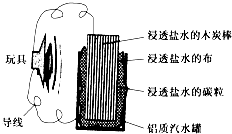 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com