
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)硝酸厂向大气中排放NO2造成的环境问题是_______________。
(2)为了减少SO2的排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO2,同时又可得到化肥。上述洗涤剂X可以是______(选填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3·H2O
(3)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中形成的化学键是___________(填化学键的类型)。用NaOH溶液吸收少量SO2的离子方程式为____________。
(4)已知:2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=_______。
SO3(g)+NO(g) △H=_______。
(5)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率以[a(NO2)]。部分实验结果如图所示:
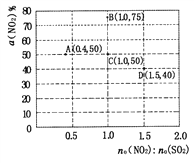
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_________;
②若A点对应实验中,SO2(g)的起始浓度为c0 mol·L-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)= ____mol·L·min-1;
③图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断:Tc_____ Td (填“>”、“=”或“<”)。
【答案】 酸雨、光化学烟雾 bd 共价键 SO2+2OH-=SO32-+H2O -41.8kJ/mol 降低温度 ![]() =
=
【解析】(1)硝酸厂向大气中排放NO2造成的环境问题是酸雨、光化学烟雾等;(2)SO2是酸性氧化物,由于同时又可得到化肥,因此洗涤剂应该是碳酸钾或氨水,答案选bd;(3)发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中生成亚硝酸根、硝酸根和水,形成的化学键是共价键;用NaOH溶液吸收少量SO2反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-=SO32-+H2O;(4)①2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1,盖斯定律计算(②-①)×1/2
得到NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol;
(3)NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol,反应为气体体积不变的放热反应,则
①如果要将图中C点的平衡状态改变为B点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度平衡正向进行;②A.点平衡转化率为50%,n(NO2):n(SO2)=0.4,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=0.4c0mol/L,反应的二氧化氮浓度=0.4c0mol/L×50%=0.2c0mol/L,该时段化学反应速率v(NO2)=0.2cmol/L÷tmin=c0/5tmol/(Lmin);③NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol,反应为放热反应n(NO2):n(SO2)=1,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=c0mol/L,图中C、D两点对应的实验温度分别为Tc和Td,C点二氧化氮转化率为50%,
NO2(g)+SO2(g)SO3(g)+NO(g)
起始浓度(mol/L)c0 c0 0 0
变化浓度(mol/L)0.5c0 0.5c0 0.5c0 0.5c0
平衡浓度(mol/L)0.5c0 0.5c0 0.5c0 0.5c0
平衡常数K=1
D点二氧化氮转化率40%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=1.5c0mol/L,则
NO2(g)+SO2(g)SO3(g)+NO(g)
起始浓度(mol/L) 1.5c0 c0 0 0
变化浓度(mol/L) 0.6c0 0.6c0 0.6c0 0.6c0
平衡浓度(mol/L) 0.9c0 0.4c0 0.6c0 0.6c0
平衡常数K=1
平衡常数相同说明反应温度相同,Tc=Td。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为______________。
(2)下列物质在一定条件下能跟丁子香酚反应的是___________。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
①与NaHCO3溶液反应
②苯环上只有两个取代基
③苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO

A→B的化学方程式为_______________________,C中滴加少量溴水振荡,主要现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,人体的“第七营养素”木质索是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是

A. 芥子醇的分子式是C11H14O4,属于芳香烃
B. 1mol芥子醇最多可与3molH2加成
C. 芥子醇分子中可能所有原子都共面
D. 芥子醇能发生的反应类型有氧化、取代、加成、加聚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列三种物质①乙醇、②碳酸、③水,它们与钠反应产生氢气的速率由大到小的顺序是( )
A. ①>②>③B. ②>①>③C. ③>①>②D. ②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a 20分钟后冷却至室温。
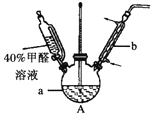
①仪器b的名称是_________;
②能说明甲醛具有还原性的实验现象是_________________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
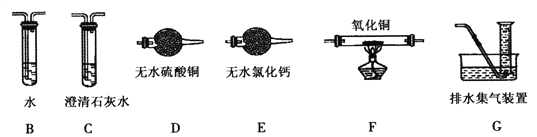
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_____________。有H2的实验现象是_________________________。
(3)已知:![]() 设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为研究其组成,进行如下实验(以下每步均充分反应):
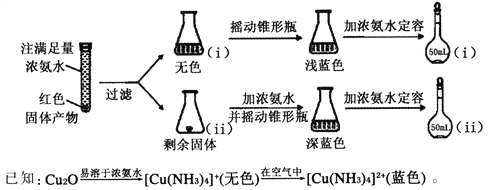
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
回答下列问题:
(1)写出对应元素的名称:A__________、B__________、C__________、X__________、Y__________、Z__________
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):__________
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:__________。
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:
__________。
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和">"、"<"或"="表示:)__________并说明理由__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,下列有机物能够合成
,下列有机物能够合成![]() 的组合是( )
的组合是( )
①1,3-丁二烯 ②2-甲基-l,3-丁二烯 ③1,3-戊二烯 ④2,3-二甲基-l,3-丁二烯
⑤2,3-二甲基-l,3-戊二烯 ⑥乙炔 ⑦丙炔 ⑧2-丁炔
A. ①、⑦及④、⑧ B. ⑤、⑥及③、⑧
C. ①、③及②、⑧ D. ②、⑧及④、⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com