
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、CO32-、Cl- | ||
| C. | Na+、Ca2+、NO3-、CO32- | D. | Na+、K+、Cl-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,可先在量筒中加入一定体积蒸馏水,再沿量筒内壁慢慢注入浓硫酸,并用玻璃棒不断搅拌 | |
| B. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸的一边,漏斗里的溶液应低于滤纸的边缘 | |
| C. | 燃着的酒精灯不慎打翻,应立即用水灭火 | |
| D. | 用药匙或纸槽把粉末状药品送入到试管的底部,如果没有试管夹,可以临时手持试管给固体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{14M}{{a}^{3}{N}_{A}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  目的:验证乙炔的还原性 | |
| B. |  目的:收集氨气 | |
| C. |  操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. | 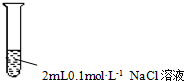 操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com