

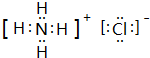 ,I的化学式Mg(OH)2;
,I的化学式Mg(OH)2;分析 D是空气中含量最多的气体,则D为N2,C是由三种短周期非金属元素组成的离子化合物,C为铵盐,A为气体非金属单质,与氢化物B反应得到铵盐C与氮气,A具有强氧化性,且E与二氧化锰反应得到A,则A为Cl2,B为NH3,C为NH4Cl,E为HCl,X为浓硫酸或浓磷酸,P是金属单质,金属P与E反应生成J,J能与A反应生成K,且A与P反应可以得到K,则金属P为变价金属,可推知P为Fe、J为FeCl2,K为FeCl3,J与Y反应得到白色沉淀L,L可以转化为M,K与Y反应也得到M,且C与Y反应得到B,则Y为强碱Ca(OH)2,L为Fe(OH)2、M为Fe(OH)3,金属单质N与氮气反应得到H,Z为液体,二者反应得到白色沉淀I与氨气,则N为Mg、Z为H2O,H为Mg3N2,I为Mg(OH)2,白色沉淀F不溶于硝酸,可以由氯气与W或HCl与G得到,而氨气与W得到G,可推知F为AgCl,W为AgNO3,G为银氨溶液,验证符合转化关系,据此解答.
解答 解:D是空气中含量最多的气体,则D为N2,C是由三种短周期非金属元素组成的离子化合物,C为铵盐,A为气体非金属单质,与氢化物B反应得到铵盐C与氮气,A具有强氧化性,且E与二氧化锰反应得到A,则A为Cl2,B为NH3,C为NH4Cl,E为HCl,X为浓硫酸或浓磷酸,P是金属单质,金属P与E反应生成J,J能与A反应生成K,且A与P反应可以得到K,则金属P为变价金属,可推知P为Fe、J为FeCl2,K为FeCl3,J与Y反应得到白色沉淀L,L可以转化为M,K与Y反应也得到M,且C与Y反应得到B,则Y为强碱Ca(OH)2,L为Fe(OH)2、M为Fe(OH)3,金属单质N与氮气反应得到H,Z为液体,二者反应得到白色沉淀I与氨气,则N为Mg、Z为H2O,H为Mg3N2,I为Mg(OH)2,白色沉淀F不溶于硝酸,可以由氯气与W或HCl与G得到,而氨气与W得到G,可推知F为AgCl,W为AgNO3,G为银氨溶液,验证符合转化关系.
(1)由上述分析可知,C为NH4Cl,电子式为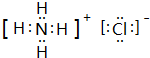 ,I的化学式为Mg(OH)2,
,I的化学式为Mg(OH)2,
故答案为: ;Mg(OH)2;
;Mg(OH)2;
(2)Fe在氯气中反应的实验现象为:产生棕色的烟,故答案为:产生棕色的烟;
(3)反应②的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
反应③的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
反应④的离子方程式为:[Ag(NH3)2]++2H++Cl-=2NH4++AgCl↓,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3;[Ag(NH3)2]++2H++Cl-=2NH4++AgCl↓;
(4)由氯化铵制取HCl时反应物氯化铵的状态是固体,由FeCl2制取Fe(OH)2时反应环境是无氧环境,故答案为:固体;无氧.
点评 本题考查无机物推断,题目涉及转化关系较多,需要学生熟练掌握元素化合物知识,注意充分利用题目信息结合转化关系推断,B到F的转化为易错点、难点,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Fe2(SO4)3═Fe3++SO42- | ||
| C. | KClO3═K++Cl-+3O2- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
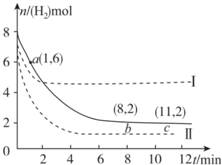 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和足量的氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2 Fe2++4 Br-+3 Cl2═2 Fe3++2 Br2+6 Cl- | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 碳酸氢铵稀溶液中加入过量的石灰水:Ca2++HCO3-+2 OH-+NH4+═CaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和叁键 | |
| D. | 多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com