
��2molSO2��1molO2��������ݻ�Ϊ2L���ܱ������У���800 Kʱ���������·�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����Ӧ�ӿ�ʼ���е�5minʱ����Ӧ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1 mol��
2SO3(g)����Ӧ�ӿ�ʼ���е�5minʱ����Ӧ�ﵽƽ��״̬����û�����������ʵ���Ϊ2.1 mol��
��ش��������⣺
(1)800Kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ____����0��5minʱ������SO2�ķ�Ӧ����Ϊ_____��
(2)����5minʱ�����¶ȣ���ijһʱ�����´ﵽƽ��״̬������ƽ������������������ʵ���________2��1 mol(�>������<������)����������ж����ɣ�__________��
(3)����ͬ�����£���������ڷֱ����xmolSO2��ymolO2��zmolSO3����Ӧ�ﵽƽ��ʱ�������ڻ�����������ʵ�����Ϊ2��1 mol����x��y��z��������Ĺ�ϵ��_________��
(һ���ú�x��z��ʽ�ӱ�ʾ��һ���ú�y��z��ʽ�ӱ�ʾ)
(4)��ͬ�����£��������������У�����0��2 mol SO2��0��4 mol O2��4��0molSO3�������壬���жԸ÷�Ӧ״̬�������У���ȷ����________(����ĸ���)��
A������ƽ��״̬
B������ƽ��״̬����Ӧ�������
C������ƽ��״̬����Ӧ�������
 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2molSO2��1molO2�����������ɱ䣬ѹǿ�㶨���ܱ������У���һ���¶��·������·�Ӧ��2SO2��g��+O2��g��
��2molSO2��1molO2�����������ɱ䣬ѹǿ�㶨���ܱ������У���һ���¶��·������·�Ӧ��2SO2��g��+O2��g��| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
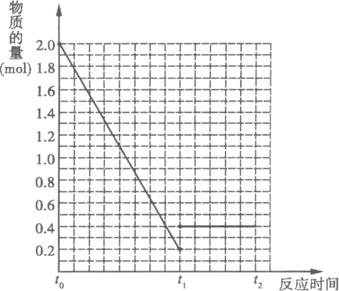
(1)��Ӧ���е�t1ʱ��SO2���������___________;
(2)����t1ʱ����һ���������(Ar)��SO2�����ʵ�����___________(�������С�����䡱)��
(3)����t1ʱ���£����´ﵽƽ��״̬����ƽ������������������ʵ���___________2.1 mol(�������������=��)������˵��ԭ��____________________________________________��
(4)�������������䣬��t1ʱ�ټ���0.2 molSO2��0.1 mol O2��1.8 mol SO3����ͼ��������t0![]() t1
t1![]() t2�����ʱ����SO2�����ʵ����仯���ߡ�
t2�����ʱ����SO2�����ʵ����仯���ߡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com