
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 陶瓷、水泥和光导纤维均属于硅酸盐材料 | |
| C. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
分析 A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液;
B.光导纤维的主要成分为二氧化硅,不属于硅酸盐;
C.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成;
D.有新物质生成的是化学变化.
解答 解:A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.陶瓷、水泥和玻璃为硅酸盐产品,而光导纤维的主要成分为二氧化硅,不属于硅酸盐产品,故B错误;
C.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,前两者为气态污染物,最后一项颗粒物才是加重雾霾天气污染的罪魁祸首.它们与雾气结合在一起,让天空瞬间变得灰蒙蒙的,“煤改气”、“煤改电”等清洁燃料改造工程减少了二氧化硫、氮氧化物和可吸入颗粒物,故有利于减少雾霆天气,故C正确;
D.石油裂解、煤的干馏、玉米制醇、蛋白质的变性过程均生成了新的物质,是化学变化,故D正确;
故选B.
点评 本题综合考查常见物质的组成、性质的应用,为高考常见题型,题目难度不大,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性.


科目:高中化学 来源: 题型:选择题
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,只能形成一个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | N2分子中一个σ键,两个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
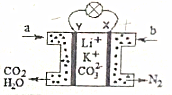 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
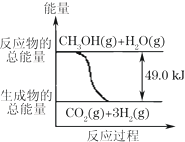 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
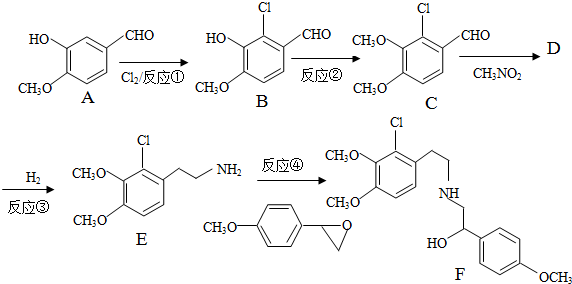
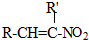 +H2O
+H2O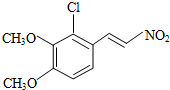 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E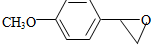 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式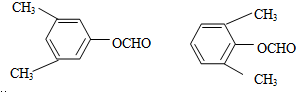 .
.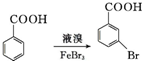 .写出以
.写出以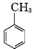 为原料制备
为原料制备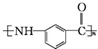 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
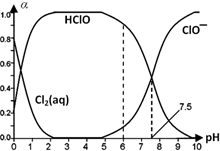 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com