
 .
.分析 (1)有机物A只含有C、H、O三种元素,其相对分子质量为84,8.4g有机物A的物质的量为:$\frac{8.4g}{84g/mol}$=0.1mol,充分燃烧后将产生的热气体(无有机物)先通过足量的无水CaCl2固体,发现该固体增重7.2g,故燃烧生成水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,再将该剩余气体通入足量的澄清石灰水,石灰水增重22.0g,故 CO2的物质的量为:$\frac{22.0g}{44g/mol}$=0.5mol,故有机物A中C原子数目为:5,H原子数目为8,根据相对分子量计算出含有氧原子的数目,然后写出A的分子式;该有机物的不饱和度为:$\frac{5×2+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个-OH连接在同一C原子上,据此写出有机物A的结构简式;
(2)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式书写.
解答 解:(1)有机物A只含有C、H、O三种元素,其相对分子质量为84,8.4g有机物A的物质的量为:$\frac{8.4g}{84g/mol}$=0.1mol,充分燃烧后将产生的热气体(无有机物)先通过足量的无水CaCl2固体,发现该固体增重7.2g,故燃烧生成水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,再将该剩余气体通入足量的澄清石灰水,石灰水增重22.0g,故 CO2的物质的量为:$\frac{22.0g}{44g/mol}$=0.5mol,故有机物A中C原子数目为:5,H原子数目为8,根据相对分子量计算出含有氧原子的质量为:84-5×12-8=16,即数目为:$\frac{16}{16}$=1,故此有机物的分子式为:C5H8O,该有机物的不饱和度为:$\frac{5×2+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,则该有机物分子中含有2个CH3、1个-OH连接在同一C原子上,所以A的结构简式为: ,故答案为:C5H8O;
,故答案为:C5H8O; ;
;
(2)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式可知,B中还含有-CHO,故B为(CH3)2C=CHCHO,
故答案为:(CH3)2C=CHCHO.
点评 本题考查有机物分子式、结构简式的计算,题目难度中等,明确有机物结构与性质为解答本题的据此,注意掌握确定常见有机物分子式、结构简式的方法,试题有利于培养学生的分析、理解能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
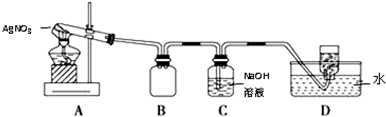
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
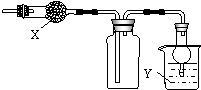 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠溶液 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假若为平面四边形,则有三种同分异构体 | |
| B. | 假若为四面体,则有两种同分异构体 | |
| C. | 假若为平面四边形,则无同分异构体 | |
| D. | 假若为四面体,则无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com