
【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
【答案】 F Na HF HCl Na Mg O F ![]() 第3周期第ⅢA族 Al3+ < Na+ < O2- NaH+H2O=NaOH+H2↑ b
第3周期第ⅢA族 Al3+ < Na+ < O2- NaH+H2O=NaOH+H2↑ b
【解析】本题考查的是元素周期表和元素周期律的内容,难度不大,掌握元素金属性和非金属性的变化规律是关键。
Ⅰ.结合元素周期表分析,①为锂,②为碳,③为氧,④为氟,⑤为氖,⑥为钠,⑦为镁,⑧为硫,⑨为氯。(1)根据元素周期律分析,在周期表中最右上角的元素的非金属性最强,在周期表中最左下角的元素金属性最强,所以氟非金属性最强,钠金属性最强;(2)氟的非金属性比氯强,所以形成的氢化物的稳定性中氟化氢比氯化氢强;(3)根据电子层数越多,半径越大,相同电子层数的原子,最外层电子数越多半径越小分析,原子半径由大到小的顺序为: Na> Mg> O>F;Ⅱ. A、B、W、D、E为短周期元素,且原子序数依次增大, A、W能形成两种液态化合物A2W和A2W2,则A为氢元素,W为氧元素,形成水和双氧水。因为A、D同主族,所以D为钠元素。E为第三周期,所以根据元素的周期序数与主族序数相等,该元素为铝元素。结合五种元素核内质子数之和为39,B、W同周期,则B为6号元素碳。 (1) A2W为水,电子式为![]() ; (2)铝元素在第3周期第ⅢA族;(3)氧离子和钠离子和铝离子电子层结构相同,根据核电荷数越大,半径越小分析,半径顺序为Al3+ < Na+ < O2-; (4)氢和钠化合生成氢化钠,和水反应生成氢气,方程式为:NaH+H2O=NaOH+H2↑;(5)比较钠和铝的金属性的强弱,可以将钠和铝分别投入水中,钠和水反应而铝和水不反应,不能将钠投入铝的盐溶液中,因为钠先与水反应,不能比较金属性强弱,可以比较最高价氧化物对应水化物的碱性强弱,不能比较其溶解性强弱,故选b。
; (2)铝元素在第3周期第ⅢA族;(3)氧离子和钠离子和铝离子电子层结构相同,根据核电荷数越大,半径越小分析,半径顺序为Al3+ < Na+ < O2-; (4)氢和钠化合生成氢化钠,和水反应生成氢气,方程式为:NaH+H2O=NaOH+H2↑;(5)比较钠和铝的金属性的强弱,可以将钠和铝分别投入水中,钠和水反应而铝和水不反应,不能将钠投入铝的盐溶液中,因为钠先与水反应,不能比较金属性强弱,可以比较最高价氧化物对应水化物的碱性强弱,不能比较其溶解性强弱,故选b。


科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中存在两种含氧官能团
B. 1mol该有机物可以分别与3molBr2和5molH2发生加成反应
C. 该有机物可以使溴水和酸性高锰酸钾溶液均褪色
D. 该有机物可以发生氧化反应、加成反应、取代反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相似相溶(经验规律):一般来说,由极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。以下可以用相似相溶规律说明的是( )
A. Cl2可溶于水 B. I2可溶于水
C. HCl易溶于水 D. NH3易溶于苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图象的是( ) 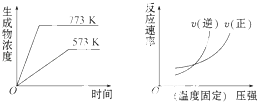
A.N2(g)+3H2(g)2NH5(g)△H=﹣Q1kJmol﹣1(Q1>0)
B.2SO5(g)2SO2(g)+O2(g)△H=+Q2kJmol﹣1(Q2>0)
C.4NH5(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣Q3kJmol﹣1(Q3>0)
D.H2(g)+CO(g)C(g)+H2O(g)△H=+Q4kJmol﹣1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。
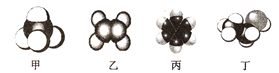
(1)可以鉴别甲和乙的试剂为__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是______(填名称),将其加入溴水中,振荡后静置,观察到的现象是______。
(3)以乙为主要原料合成乙酸,合成路线如图所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
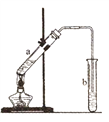
①丁生成A的化学方程式为_______________;
②如图,丁与乙酸在浓硫酸作用下发生反应,当观察到b试管中有明显现象时,停止实验。生成的有机物的结构简式为___________;试管b中的溶液是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液稀释至10倍后pH=4
C.0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡.
(1)氨水是中学常见的碱溶液 ①下列事实可证明NH3H2O是弱碱的是(填字母序号).
A.常温下,0.1molL﹣1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0.1molL﹣1氯化铵溶液的pH为5
D. 铵盐受热易分解
②下列方法中,可以使氨水电离程度增大的是(填字母序号).
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸 用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.
①滴定醋酸的曲线是(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字): c(H+)﹣c(NH3﹒H2O)=mol/L.
(4)铵盐和氯化银是中学常见盐 ①0.1molL﹣1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较(填溶质的化学式)溶液中NH4+的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl﹣(aq)
在25℃时,AgCl的Ksp=1.8×10﹣10 . 现将足量AgCl分别放入下列液体中:
①100mL蒸馏水
②100mL 0.3molL﹣1AgNO3溶液
③100mL 0.1molL﹣1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com