
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
分析 依据影响水电离的因素分析判断,水的电离过程是吸热过程,升温促进电离,加入酸或碱抑制水的电离,加入能水解的盐或和水反应的物质促进水的电离,温度一定溶液中离子积常数不变等来解答.
解答 解:A、水的电离吸热,将水加热,平衡向正反应方向移动,KW增大,故A错误;
B、向水中加入少量NaOH固体,c(OH-)增大,平衡向逆向移动,故B错误;
C、向水中加入少量盐酸,c(H+)增大,平衡向逆向移动,故C正确;
D、由水的电离方程式可知水电离出c(OH-)和 c(H+)相等,向水中加少量CH3COONa固体,醋酸根离子与水电离的氢离子结合生成醋酸,降低了氢离子浓度,平衡正向移动,c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了水的电离平衡的影响因素和水的离子积常数,综合性较强,题目难度中等,特别注意在任何情况下由水电离出c(OH-)和 c(H+)相等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
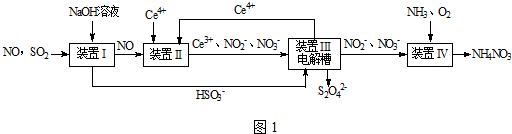
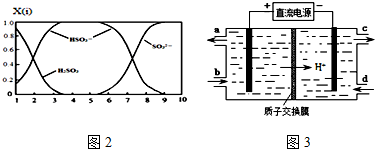
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 2-丁炔 | C. | 1-丁烯 | D. | 2-甲基丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH>Mg(OH)2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3<PH3<SiH4 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
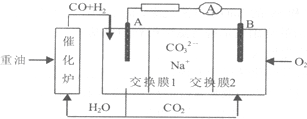
| A. | 重油是石油分馏的产品,含有的主要元素为C、H、O | |
| B. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com