
已知: ,在NH4CuSO4中加入足量3mol/L硫酸后,下列叙述正确的是
,在NH4CuSO4中加入足量3mol/L硫酸后,下列叙述正确的是
| A.有刺激性气味的氨气产生 |
| B.若有1mol NH4CuSO4参加反应,将转移3mol e— |
| C.硫酸在反应中作氧化剂 |
| D.所得溶液呈蓝色 |
科目:高中化学 来源: 题型:
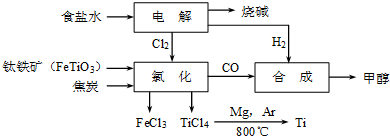
查看答案和解析>>
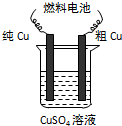
科目:高中化学 来源: 题型:
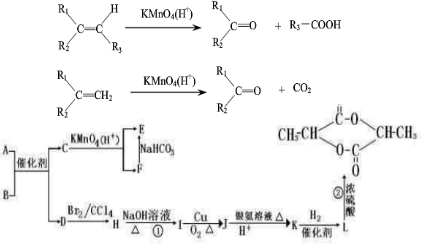
 (2010?湖北模拟)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH
(2010?湖北模拟)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH查看答案和解析>>
科目:高中化学 来源: 题型:


| 一定条件 |
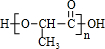 +(n-1)H2O
+(n-1)H2O| 一定条件 |
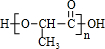 +(n-1)H2O
+(n-1)H2O

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
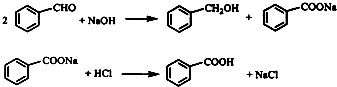
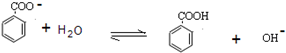
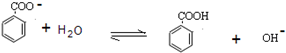
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com