
 已知298K时:
已知298K时:| c |
| 2 |
| c |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| cmol/L |
| 2min |
| c |
| 2 |
| c |
| 2 |
| 1 |
| 2 |
| 0.04 | ||
0.01×
|


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:0114 月考题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
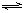 2NH3(g)ΔH=-92.2kJ?mol-1 ΔS=-198.2J?mol-1?K-1。
2NH3(g)ΔH=-92.2kJ?mol-1 ΔS=-198.2J?mol-1?K-1。查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时下列反应:
Ca(s)+C(s)+![]() O2(g)=CaCO3(s);△H=-1206.8kJ?mol―1 ①
O2(g)=CaCO3(s);△H=-1206.8kJ?mol―1 ①
Ca(s)+![]() O2(g)=CaO(s);△H=-635.1kJ?mol―1 ②
O2(g)=CaO(s);△H=-635.1kJ?mol―1 ②
CaCO3(s)=CaO(s)+CO2(g);△H=+178.2kJ?mol―1 ③
则该温度下12g C完全燃烧的热化学方程式为_____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com