
以下三组溶液:①汽油和硫酸钠溶液 ②42%的乙醇溶液 ③氯化钠和碘的水溶液
分离以上各混合液的方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:填空题
研究氮、硫及卤素(F、Cl、Br、I)等单质及其化合物的反应在工农业生产、日常生活和环境保护中有重要意义。
(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,该反应的化学方程式为 。NH3的电子式为 。硝酸生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把一氧化氮还原成无色无毒气体,直接排入空气中,有关反应的化学方程式为 。
(2)已知在加热条件下浓硫酸能将木炭粉氧化,该反应的化学方程式为 。某学习小组设计实验来验证上述反应所产生的各种产物,将该反应生成的气体依次通过①装有无水硫酸铜的U型管 ②装有品红溶液的洗气瓶 ③装有酸性KMnO4溶液的洗气瓶 ④装有品红溶液的洗气瓶 ⑤装有澄清石灰水的烧杯,实验中能说明产物内含有CO2的现象是 。
(3)某学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。该小组设计的实验操作依次为:①向NaBr溶液中通入氯气 ②向KI溶液中通入氯气,若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是 (用离子方程式表示)。从原子结构的角度解释氯、溴、碘氧化性逐渐减弱的原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次诊断测试化学试卷(解析版) 题型:选择题
在标准状况下,1体积水溶解224体积氨气,所得溶液密度为0.9g/cm3,这种氨水的物质的量浓度和质量分数分别为
A.7.69mol/L 14.5% B.8.15 mol/L 15.4%
C.7.69 mol/L 15.4% D.8.17 mol/L 14.5%
查看答案和解析>>
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:选择题
原子序数依次增大的四种短周期元素X、Y、Z、M。其中Z是金属元素,X的原子半径小于Y,Y与M同主族,Y的质子数为M的1/2。下列说法一定正确的是
A.X与M的原子序数之差为31
B.Y的离子半径小于Z的离子半径
C.由X与Z组成的化合物,可与水反应放出X2
D.由M与Y组成的化合物,其水化物是强酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.稀硫酸与氢氧化钡溶液反应:H++OH一=H2O
B.钠与水反应: Na+ H2O=Na++OH一+ H2↑
C.铝与氢氧化钠溶液反应:2Al+2OH一+2H2O=2A1O2一+3 H2↑
D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期半期考试化学试卷(解析版) 题型:选择题
有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
溶液 | 甲+乙[来 | 乙+丙 | 丙+丁 | 甲+丁 |
现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是
A.HCl、BaCl2、H2SO4、Na2CO3
B.H2SO4、HCl、BaCl2、Na2CO3
C.HCl、H2SO4、BaCl2、Na2CO3
D.H2SO4、Na2CO3、HCl、BaCl2
查看答案和解析>>
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:填空题
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol?L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是_________(填化学式)。写出以上过程中涉及到的化学反应方程式,如果是离子反应,用离子反应方程式表示 。
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为______________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
______Cu2S+______Fe3++____H2O _____Cu2++______Fe2++______( )+______SO42- 。
_____Cu2++______Fe2++______( )+______SO42- 。
(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:推断题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
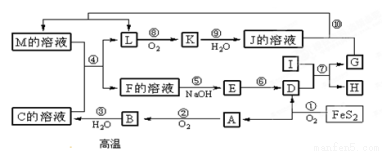
请填写下列空白:
(1)在周期表中,组成单质I的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是__________(填序号)
(4)反应④的离子方程式是__________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是 _________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com