
分析 根据n=$\frac{m}{M}$计算NaOH物质的量,再根据V=$\frac{n}{c}$计算溶液体积;
没有450mL容量瓶,应选择500mL容量瓶,配制溶液体积为500mL,根据n=cV计算CuSO4的物质的量,再根据m=nM计算CuSO4的质量.
解答 解:10g NaOH物质的量为$\frac{10g}{40g/mol}$=0.25mol,则溶液体积为$\frac{0.25mol}{2mol/L}$=0.125L=125mL,
没有450mL容量瓶,应选择500mL容量瓶,配制溶液体积为500mL,CuSO4的物质的量为0.5L×0.5mol=0.25mol,则CuSO4的质量为0.25mol×160g/mol=40g,
故答案为:125;40.
点评 本题考查物质的量有关计算、一定物质的量浓度溶液配制,注意中学常用容量瓶规格.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 氨基钠和氢化钠的晶体中都只含离子键 | |
| D. | 方程式①中,氨基钠是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期ⅢA族 | B. | 第2周期ⅥA族 | C. | 第3周期ⅤA族 | D. | 第3周期ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×1022个 | B. | 2.5×1019个 | C. | 5×1022个 | D. | 5×1019个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
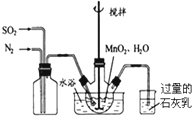 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置Ⅰ:观察Fe(OH)2的生成 | B. | 装置Ⅱ:除去Cl2中的HCl | ||
| C. | 装置Ⅲ:除去CCl4中的Br2 | D. | 装置Ⅳ:加热分解NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
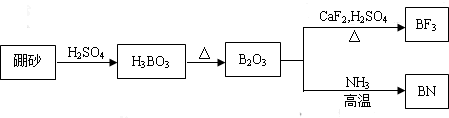
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com