
 在5-氨基四唑(
在5-氨基四唑(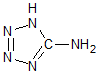 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.分析 (1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;根据价层电子对互斥理论确定其杂化方式;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
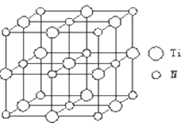
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
③根据[Ti(OH)2(H2O)4]2+中的成键特点可以判断.
解答 解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;9NA;
(3)①N3-中价层电子对=2+$\frac{1}{2}$(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线型,
故答案为:直线型;
②该晶胞中碳原子个数=8×$\frac{1}{8}$=1,N原子个数=6×$\frac{1}{2}$=3,Ti原子个数=1+12×$\frac{1}{4}$=4,所以其化学式为:Ti4CN3,
故答案为:Ti4CN3;
③根据[Ti(OH)2(H2O)4]2+中的成键特点可以看出,在这个配位离子中,水分子内部和氢氧根离子内部都是O-H单共价键,也就是σ键,水分子及氢氧根离子是配体,它们和而Ti2+之间是配位键,
故答案为:ad.
点评 本题考查电负性、化学式的确定、杂化方式的判断,配合物的结构等知识,会运用价层电子对互斥理论确定杂化方式和空间构型,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用盐酸润洗就直接注入标准盐酸 | |
| B. | 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 | |
| C. | 酸式滴定管在滴定前有气泡,滴定后气泡消失 | |
| D. | 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水蒸气、液态水和冰中,水分子都在不停地运动 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同分异构体,熔点和硬度都很高 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式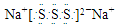 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C O (g)+O2(g)═2CO2(g) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | Zn(s)+Ag2 O(s)═Zn O(s)+2Ag(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
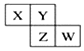 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | X的氧化物不能与Mg发生化学反应 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W与X形成的化合物中化学键类型为共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NaCl中含有Na2CO3,加水溶解 | |
| B. | 鉴别NaCl和Na2CO3溶液,加适量盐酸 | |
| C. | 除去CaO中的CaCO3,加足量稀盐酸 | |
| D. | 除去CO2中少量的CO,通入O2,点燃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com