
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
分析 A、最外层电子数相同,原子核外电子层数越多,半径越大;
B、元素的非金属性越强,对应的氢化物越稳定;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、含有氢键的沸点较高.
解答 解:A、原子核外电子层数越多,半径越大,Br、Cl与F处于同一主族,半径大小正确顺序为:Br>Cl>F,故A错误;
B、非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,即HCl>H2S>PH3,故B错误
C、非金属性P>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D、含有氢键的沸点较高,所以沸点:乙酸>乙醇>乙烷,故D正确,故选CD.
点评 本题考查学生利用燃烧通式的计算及物理性质的比较,注意规律的应用是解答本题的关键,要求学生学会归纳总结,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N2的结构式:N≡N | B. | CH4分子的比例模型: | ||
| C. | NH3分子的电子式: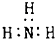 | D. | 乙醇分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加 | |
| C. | 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据 | |
| D. | 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
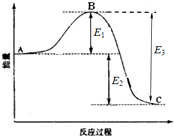 已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:
已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变物质的性质一定要通过化学变化 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 一种元素可有多种离子,但只有一种原子 | |
| D. | 放热反应一定是不需加热就能发生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
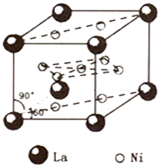 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com