
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
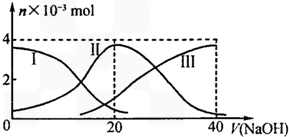 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
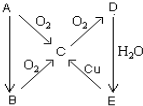 A、B、C、D、E、在一定条件下的转换条件如图所示.
A、B、C、D、E、在一定条件下的转换条件如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
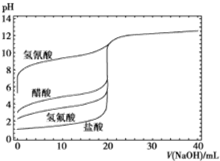 如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸时,应用酚酞做指示剂不能使用甲基橙 | |
| C. | 当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-) | |
| D. | 随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cu.Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18 g D2O中含有的质子数目为10NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2 NA | |
| D. | 常温常压下,16 g O3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:K+、MnO4+、SO42-Cl- | |
| B. | 能使甲基橙显红色的溶液:Fe2+,NO3-,Na+,SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=l0-12的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 酸性透明溶液中:Cu2+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com