
| A. | Mg | B. | Zn2+ | C. | Fe2+ | D. | H2 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高分子材料都难以降解,会造成环境污染 | |
| B. | 塑料、涂料和合成橡胶被称为“三大合成材料” | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定有分子碰撞 | B. | 化学反应的活化能一定大于零 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 发生有效碰撞的分子是活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水和盐酸反应:OH-+H+═H2O | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
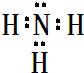 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式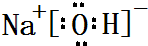 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.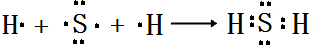 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | 仅②④⑥ | C. | 仅②③④ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用如图装置制取Fe(OH)2沉淀 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. |  用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. |  用如图装置比较Na2CO2与NaHCO3的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com