
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 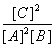
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
科目:高中化学 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、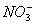 、SO
、SO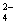 、
、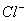 、
、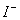 、
、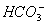 ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×12-12mol2·L-2、5.0×12-13mol2·L-2、8.3×12-17mol2·L-2。下列有关说法错误的是 ( )
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,CO和水蒸气各1mol放在密闭容器中反应:
CO(g) + H2O(g)  CO2(g) + H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 ( )
CO2(g) + H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 ( )
A.等于0.6mol B.等于1mol C.大于0.6mol小于1mol D.大于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如右图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为___________________________________;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________________。
Ⅱ(7分)将2mol H2O和2mol CO置于1L容器中,加热至高温,发生如下可逆反应:
2H2O(g)  2H2(g)+O2(g),2CO(g)+O2(g)
2H2(g)+O2(g),2CO(g)+O2(g)  2CO2(g)。
2CO2(g)。
(3)当上述系统达到平衡时,欲求混合气体的平衡组成,至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________(填分子式)。
(4)若平衡时O2和CO2的物质的量分别为a mol和b mol,则平衡时H2O的物质的量为_______________________ (用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应
式是:Zn+2OH--2e-===ZnO+H2O; Ag2O+H2O+2e-===2Ag+2OH- 下列说法
正确的是
A.Zn为正极,Ag2O为负极
B.Ag2O发生还原反应
C.原电池工作时,正极区溶液pH值减小
D.原电池工作时,负极区溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究学习小组用下图所示装置进行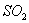 、
、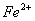 和
和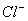 还原性强弱比较实验,实验过程如下:
还原性强弱比较实验,实验过程如下:
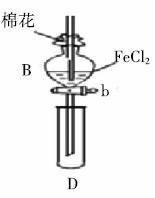
I. 先向B中的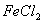 溶液(约
溶液(约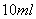 )中通入
)中通入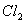 ,当B的溶液变黄时,停止通气。
,当B的溶液变黄时,停止通气。
II. 打开活塞b,使约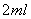 的溶液流入D试管中,检验取出溶液中的离子。
的溶液流入D试管中,检验取出溶液中的离子。
III. 接着再向B中通入一定量的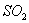 气体。
气体。
IV. 更新试管D,重复过程II,检验取出溶液中的离子。
(1)仪器B的名称是__________,棉花中浸润的溶液为__________,目的是__________。
(2)实验室制备氯气的化学方程式为__________。
(3)过程III中一定发生反应的离子方程式为__________,过程IV中检验取出溶液中是否含有硫酸根的操作是____________________。
(4)该小组对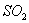 、
、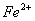 和
和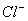 还原性强弱比较期望达到的结论是:______________。
还原性强弱比较期望达到的结论是:______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明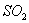 、
、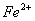 和
和 还原性强弱关系的是____________________。
还原性强弱关系的是____________________。
| 过程II中检出离子 | 过程IV中检出离子 | |
| 甲 | 有 | 有 |
| 乙 | 既有 | 有 |
| 丙 | 有 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如右图所示(无被省略的物质): 又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
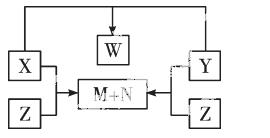
(1)上述转化关系图中涉及的基本反应类型是 ;
(2)X、Y、Z、W的化学式依次是:
X 、Y 、Z 、W ;
(3)写出X与Y、X与Z反应的化学方程式:
X+Y: ;
 X+Z: 。
X+Z: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com